
电子级钴的氧化物用于半导体工业和电子陶瓷等领域,是一种纯度很高的氧化物。其工业制取流程如下:
(1)实验室过滤所需的仪器有铁架台、铁圈、烧杯、 和漏斗。
(2)滤渣A的成分除过量的Co3(PO4)3和Fe(OH)3外还有 (填化学式),加入CO3(PO4)2的目的是 。
(3)Co与稀硝酸反应生成 Co2+的离子方程式为: 。
(4)滤渣B经过反复洗涤、干燥后,进行灼烧,其热重分析图如下:写出下列化学反应方程式:
①AB段: ;
②BC段 。
(1)玻璃棒(2)Si 调节pH,保证Co2+不沉淀,而使铁离子全部沉淀
(3)3Co+8H++2NO3-=3Co2++4H2O+2NO↑
(4)CoC2O4 CoO+CO↑+CO2↑ 6CoO+O2
CoO+CO↑+CO2↑ 6CoO+O2 2Co3O4
2Co3O4
解析试题分析:(1)实验室过滤所需的仪器有铁架台、铁圈、烧杯、玻璃棒和漏斗。(2)在加入硝酸酸化时钴、Fe都与硝酸发生反应得到硝酸钴、硝酸铁而Si不能与稀硝酸发生反应,所以过滤后存在于滤渣A中。因此滤渣A的主要成分除过量的Co3(PO4)3和Fe(OH)3外还有Si。加入CO3(PO4)2的目的是调节pH,保证Co2+不沉淀,而使铁离子全部沉淀。(3)Co与稀硝酸反应生成 Co2+,根据质量守恒定律和电子守恒、电荷守恒,可知该反应的离子方程式为3Co+8H++2NO3-=3Co2++4H2O+2NO↑。(4)滤渣B(CoC2O4)灼烧发生分解反应:CoC2O4 =CoO+CO↑+CO2↑。得到固体为CoO。n(CoC2O4)=14.7g÷147g/mol=0.1mol;根据元素守恒可得m(CoO)=0.1mol×75g/mol=7.5g;而在t3时固体的质量为8.03g.根据质量守恒定律可知在BC段发生了反应:6CoO+O2
=CoO+CO↑+CO2↑。得到固体为CoO。n(CoC2O4)=14.7g÷147g/mol=0.1mol;根据元素守恒可得m(CoO)=0.1mol×75g/mol=7.5g;而在t3时固体的质量为8.03g.根据质量守恒定律可知在BC段发生了反应:6CoO+O2 2Co3O4。
2Co3O4。
考点:考查混合物的分离方法、试剂的使用、化学方程式离子方程式的书写及有关计算的知识。


科目:高中化学 来源: 题型:填空题
(14分)废旧碱性锌锰干电池内部的黑色物质A主要含有MnO2、NH4CI、ZnCI2,还有少量的FeCI2和炭粉,用A制备高纯MnCO3,的流程图如下。
(1)碱性锌锰干电池的负极材料是_________(填化学式)。
(2)第Ⅱ步操作的目的是________________________。
(3)第Ⅳ步操作是对滤液a进行深度除杂,除去Zn2+的离子方程式为____________________。
(已知:Ksp(MnS)=2.5×10-13,Ksp(ZnS)=1.6×10-24)
(4)为选择试剂X,在相同条件下,分别用5 g黑色物质M进行制备MnSO3的实验,得到数据如右表:
①试剂x的最佳选择是_________。
②第Ⅲ步中用选出的最佳试剂X与M的主要成分反应的化学方程式为_________。
(5)已知:MnCO3难溶于水和乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀时pH为7.7。请补充完成以下操作:
第Ⅴ步系列操作可按一下流程进行:请补充完成操作:(第Ⅴ步系列操作中可供选用的试剂: 、乙醇)
、乙醇)
操作1:___________________;操作2:过滤,用少量水洗涤2~3次
操作3:检测滤液,表明SO42-已除干净; 操作4:___________________;
操作5:低温烘干。
(6)操作1可能发生反应的离子方程式
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有一无色透明溶液,欲确定是否含有下列离子: Fe2+、Mg2+、Al3+、Ba2+、 、
、 、Cl-、I-、
、Cl-、I-、 ,取该溶液进行实验:
,取该溶液进行实验:
| 实验步骤 | 实验现象 |
| (1)取少量该溶液,加几滴紫色石蕊试液 | 溶液变红 |
| (2)取少量该溶液加热,加Cu片和浓H2SO4,加热 | 有无色气体产生,气体遇空气变成红棕色 |
| (3)取少量该溶液,加BaCl2溶液 | 有白色沉淀 |
| (4)取(3)中上层清液,加AgNO3溶液 | 有白色沉淀,且不溶于稀HNO3 |
| (5)取少量该溶液,加NaOH溶液 | 有白色沉淀,NaOH过量时沉淀部分溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下:
(1)写出步骤“还原”中可能发生反应的离子方程式 、 。
(2)回收S过程中温度控制50℃~60℃之间,不宜过高或过低的原因是 、 。
(3)气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该物质的化学式为 ;向滤液M中加入(或通入)下列 (填字母)物质,得到另一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾 d.盐酸
(4)保温除铁过程中加入CuO的目的是 、 ;
(5)过滤③所得到的滤液,加入硝酸后,经操作X、过滤④得到硝酸铜晶体。
硝酸的作用是 ;
操作X是 、 (填操作名称) 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的过程如下图所示。
已知:① NaFeO2遇水强烈水解。
② Cr2O72-+ H2O 2CrO42-+ 2H+
2CrO42-+ 2H+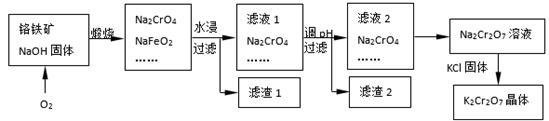
(1)K2Cr2O7中Cr元素的化合价是 。
(2)滤液1的成分除Na2CrO4、Na2SiO3外,还含有(填化学式) ;
生成滤渣1中红褐色物质反应的化学方程式是。
(3)由滤液2转化为Na2Cr2O7溶液应采取的措施是。
(4)煅烧铬铁矿生成Na2CrO4和NaFeO2反应的化学方程式是 。
(5)莫尔法是一种沉淀滴定法,以Na2CrO4 为指示剂,用标准硝酸银溶液滴定待测液,进行测定溶液中Cl-的浓度。已知:
| 银盐 性质 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
| Ksp | 1.34×10-6 | 7.1×10-7 | 1.1×10-8 | 6.5×10-5 | 1.0×10-6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某科研小组从含有较多Ag+、Fe3+、Al3+的工业废水中,按下图所示方法分离和提取金属单质:
已知:实验室甲、乙、丙、丁四种物质只能从氨水、碳酸铵、氢氧化钠、稀硫酸、葡萄糖五种溶液中选择,也可以用这五种溶液来制备。
对该实验分析正确的是
A.金属A、B、C分别为Ag、Fe、Al
B.g、f都为氧化物,工业上均采用电解g与f获得对应金属单质
C.沉淀b为混合物,主要成分为沉淀d和沉淀e
D.甲是氢氧化钠,丁为稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
用菱锰矿(MnCO3)常含有Fe2O3、FeO、HgCO3·2HgO等杂质,工业常用菱锰矿制取锰,工艺流程如下:
请回答下列问题:
(1)向粗液1中加入的水最后需要 方法才能达到技术要求。
(2)流程中用的空气是用膜分离法制备的富氧空气,该方法的原理是 。
(3)净化剂主要成分为(NH4)2S,粗液2中发生主要反应的离子方程式为 。
(4)写出阳极的电极反应式 。说明电解液循环的原因 。
(5)写出铝热法炼锰的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
磷酸铁锂(LiFePO4)被认为是最有前途的锂离子电池正极材料。某企业利用富铁浸出液生成磷酸铁锂,开辟了处理硫酸亚铁废液一条新途径。其主要流程如下: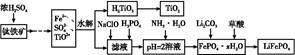
已知:H2TiO3是种难溶于水的物质。
(1)钛铁矿用浓硫酸处理之前,需要粉碎,其目的是 。
(2)TiO2+水解生成H2TiO3的离子方程式为 。
(3)加入NaClO发生反应的离子方程式为 。
(4)在实验中,从溶液中过滤出H2TiO3后,所得滤液浑浊,应如何操作 。
(5)为测定钛铁矿中铁的含量,某同学取经浓硫酸等处理的溶液(此时钛铁矿中的铁已全部转化为二价铁离子),采取KMnO4标准液滴定Fe2+的方法:(不考虑KMnO4与其他物质反应)在滴定过程中,若未用标准液润洗滴定管,则使测定结果 (填“偏高”、“偏低”或“无影响”),滴定终点的现象是 。滴定分析时,称取a g钛铁矿,处理后,用c mol/L KMnO4标准液滴定,消耗V mL,则铁元素的质量分数的表达式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com