
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的过程如下图所示。
已知:① NaFeO2遇水强烈水解。
② Cr2O72-+ H2O 2CrO42-+ 2H+
2CrO42-+ 2H+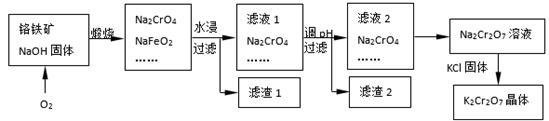
(1)K2Cr2O7中Cr元素的化合价是 。
(2)滤液1的成分除Na2CrO4、Na2SiO3外,还含有(填化学式) ;
生成滤渣1中红褐色物质反应的化学方程式是。
(3)由滤液2转化为Na2Cr2O7溶液应采取的措施是。
(4)煅烧铬铁矿生成Na2CrO4和NaFeO2反应的化学方程式是 。
(5)莫尔法是一种沉淀滴定法,以Na2CrO4 为指示剂,用标准硝酸银溶液滴定待测液,进行测定溶液中Cl-的浓度。已知:
| 银盐 性质 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
| Ksp | 1.34×10-6 | 7.1×10-7 | 1.1×10-8 | 6.5×10-5 | 1.0×10-6 |
(1)+6(2分)
(2)NaOH、NaAlO2;(2分,只写一项得1分,多写或错写得0分)
NaFeO2+2H2O=Fe(OH)3↓+NaOH;(3分)
(3)加硫酸酸化(2分)
(4)4[FeO·Cr2O3] + 7O2 + 20NaOH 8Na2CrO4 + 4NaFeO2+ 10H2O(3分)
8Na2CrO4 + 4NaFeO2+ 10H2O(3分)
(5)①滴入最后一滴标准溶液,生成砖红色沉淀,且30s内沉淀不消失(2分)②B (2分)
解析试题分析:(1)根据化合物中各元素的化合价代数和为0的原则判断K2Cr2O7中Cr元素的化合价是+6价;
(2)由流程图判断,滤液1的成分除Na2CrO4、Na2SiO3外,氧化铝与氢氧化钠反应生成的NaAlO2,还含有过量的NaOH;
滤渣1是红褐色的氢氧化铁,是NaFeO2水解生成的,化学方程式为NaFeO2+2H2O=Fe(OH)3↓+NaOH;
(3)滤液2中存在Cr2O72-+ H2O 2CrO42-+ 2H+,由滤液2转化为Na2Cr2O7溶液应使平衡逆向移动,所以应加酸酸化;
2CrO42-+ 2H+,由滤液2转化为Na2Cr2O7溶液应使平衡逆向移动,所以应加酸酸化;
(4)流程图的第一步是铬铁矿在加热条件下与氢氧化钠、氧气反应生成Na2CrO4和NaFeO2,化学方程式为
4[FeO·Cr2O3] + 7O2 + 20NaOH 8Na2CrO4 + 4NaFeO2+ 10H2O
8Na2CrO4 + 4NaFeO2+ 10H2O
(5)①由沉淀的溶度积判断,滴入硝酸银溶液时先生成氯化银白色沉淀,氯离子沉淀完全后才生成Ag2CrO4的砖红色沉淀,所以滴定终点时有砖红色沉淀生成。②若用AgNO3溶液滴定NaSCN溶液,AgSCN与AgCl、AgBr相比,溶解度较大,所以若选用AC,则先生成AgCl、AgBr,而且颜色变化不明显,选用B,则先生成AgSCN,终点时有砖红色沉淀生成,所以选择K2CrO4可以指示滴定终点。
考点:考查对流程图的分析,物质的判断,平衡的移动,化学方程式的书写,沉淀的转化


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:单选题
下列实验能达到目的的是
| A.用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸 |
| B.用NaOH溶液与FeCl3溶液制备Fe(OH)3胶体 |
| C.用品红和盐酸检验Na2SO3和Na2CO3 |
| D.将混有乙烯的SO2通入酸性KMnO4溶液中除去乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)工业上SnSO4是一种重要的硫酸盐,广泛应用于镀锡工业,其制备路线如下:
提示:①已知在酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式.
②已知Ksp[Sn(OH)2] =1.0×10-26
回答下列问题:
(1)SnCl2用盐酸而不用水直接溶解的原因是__________,加入Sn粉的作用是_________。
(2)反应I生成的沉淀为SnO,写出该反应的离子方程式___________________________。
(3)检验沉淀已经“漂洗”干净的方法__________________________________________。
(4)反应Ⅱ硫酸的作用之一是控制溶液的pH,若溶液中c(Sn2+)=1.0mol?L-1,则应控制溶液pH_____。
(5)酸性条件下,SnSO4还可以用作双氧水去除剂,请写出发生反应的离子方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
利用工业炼铜后的炉渣(含Fe2O3、FeO、SiO2、Al2O3),制备无机高分子絮凝剂聚合氯化铝和净水剂高铁酸钠(Na2FeO4)。其工艺流程如下(部分操作和条件略):
Ⅰ.用稀盐酸浸取炉渣,过滤;
Ⅱ.向滤液中加入过量NaClO溶液,调pH约为3,过滤;
Ⅲ.溶液进行减压蒸发等操作,甩干后送入聚合炉中进行高温聚合,……得到聚合氯化铝。
Ⅳ.将Ⅱ中得到沉淀洗涤、干燥,再与NaClO和NaOH反应,生成高铁酸钠。
(1)稀盐酸溶解Fe2O3的离子方程式是 。
(2)验证炉渣中含有FeO必要的化学试剂为 。
(3)已知:生成氢氧化物沉淀的pH
| 物质 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀时 | 1.5 | 3.4 | 6.3 |
| 完全沉淀时 | 2.8 | 4.7 | 8.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
电子级钴的氧化物用于半导体工业和电子陶瓷等领域,是一种纯度很高的氧化物。其工业制取流程如下:
(1)实验室过滤所需的仪器有铁架台、铁圈、烧杯、 和漏斗。
(2)滤渣A的成分除过量的Co3(PO4)3和Fe(OH)3外还有 (填化学式),加入CO3(PO4)2的目的是 。
(3)Co与稀硝酸反应生成 Co2+的离子方程式为: 。
(4)滤渣B经过反复洗涤、干燥后,进行灼烧,其热重分析图如下:写出下列化学反应方程式:
①AB段: ;
②BC段 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
从化工厂铬渣中提取硫酸钠的工艺如下: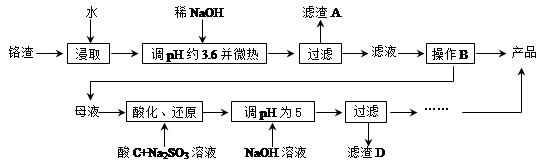
已知:①铬渣含有Na2SO4及少量Cr2O72-、Fe3+;②Fe3+、Cr3+完全沉淀(c ≤1.0×10-5 mol·L-1)时pH分别为3.6和5。
(1)“微热”除能加快反应速率外,同时还可以 ,滤渣A为 (填化学式)。
(2)根据溶解度(S)∽温度(T)曲线,操作B的最佳方法为 (填字母序号)
A.蒸发浓缩,趁热过滤
B.蒸发浓缩,降温结晶,过滤
(3)酸化后Cr2O72-可被SO32-还原成Cr3+,离子方程式为: ;酸C为 ,Cr(OH)3的溶度积常数Ksp[Cr(OH)3]= 。
(4)根据2CrO42-+2H+  Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的 极,其电极反应式为 。
Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的 极,其电极反应式为 。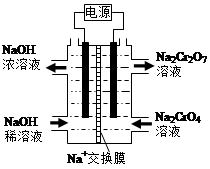
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上常回收冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质),并用来生产ZnSO4·6H2O晶体,其工艺流程如下,有关氢氧化物沉淀时的pH如下表。
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 5.4 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
锂被誉为“金属味精”,以LiCoO2为正极材料的锂离子电池已被广泛用作便携式电源。工业上常以β锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂。其中一种工艺流程如下:
已知:部分金属氢氧化物开始沉淀和完全沉淀时的pH:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
 )
)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有一混合气体,可能由H2、O2、NH3、N2、CO2、HCl和He中的两种或多种组成。常温下,取此气体200 mL进行实验,实验的过程和结果如下:
①观察此混合气体为无色。
②将此气体通过浓硫酸,气体体积减少了40 mL。
③将②中剩余的气体,通过Na2O2固体,气体体积变为120 mL。
④将③中剩余的气体引燃充分反应后,冷却至常温,气体体积又减少了105 mL。(上述气体的体积都是相同条件下测定的)。
⑤剩余气体通过加热的铜网,剩余10 mL气体。
根据上述实验,试推断:
(1)混合气体中肯定存在的气体是_________,它们的体积分别为_________。
(2)混合气体中肯定不存在的气体是__________________。
(3)混合气体中可能含有的气体是_________,其体积共为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com