
| ||
| n |
| V |
| ||
| 6.2g×2mol |
| 62g |
| 27.4g-16.8g |
| 106g/mol |
| 0.4mol |
| 0.1L |


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:
| A、Fe、Zn |
| B、Al、Cu |
| C、Al、Mg |
| D、Al、Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、50% | B、84% |
| C、42% | D、16% |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、c=
| ||
B、p=m+
| ||
| C、n=m+0.017Vc | ||
D、n=p+
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe、Zn |
| B、Fe、Cu |
| C、Cu、Mg |
| D、Al、Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 稀H2SO4 |
| ① |
| 调PH约为5 |
| 适量高锰酸钾溶液② |
| 过滤 |
| Zn |
| ③ |
| 过滤 |
| Na2CO3 |
| ④ |
| 过滤 |
| 煅烧 |
| ⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
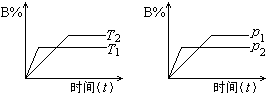 已知某可逆反应:mA(g)+nB(g)?pC(g)+Q(Q为热量变化).在密闭容器中进行,如图所示,反应在不同时间t,温度T和压强p与反应物B在混合气体中的百分含量(B%)的关系曲线,由曲线分析下列判断正确的是( )
已知某可逆反应:mA(g)+nB(g)?pC(g)+Q(Q为热量变化).在密闭容器中进行,如图所示,反应在不同时间t,温度T和压强p与反应物B在混合气体中的百分含量(B%)的关系曲线,由曲线分析下列判断正确的是( )| A、T1<T2,p1>p2,m+n>p,Q<0 |
| B、T1>T2,p2>p1,m+n>p,Q<0 |
| C、T1>T2,p2>p1,m+n<p,Q<0 |
| D、T1>T2,p1<p2,m+n>p,Q>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
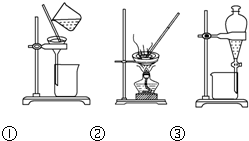
| A、洗涤沉淀时(如图①),向漏斗中加适量水,搅拌并滤干 | ||
| B、用CCl4提取碘水中的碘,选③ | ||
C、蒸馏时蒸馏烧瓶中液体的体积不能超过容积的
| ||
| D、粗盐提纯,选①和② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com