
【题目】伪麻黄碱(D)是新康泰克的成分之一能够缓解感冒时带来的鼻塞、流鼻涕和打喷嚏等症状,其中一种合成路线如下:

回答下列问题:
(1)伪麻黄碱(D)的分子式为____________;B中含有的官能团有_____________(写名称)
(2)C→D的反应类型为__________;写出B→C反应的化学方程式:_________________;
(3)B的消去产物可以用于合成高分子化物E,请写出E的结构简式_____________;
(4)A的同分异构体满足下列要求:①能发生银镜反应 ②苯环上的一氯代物有两种结构;③核磁共振氢谱有4组峰,且峰面积之比为6:2:1:1写出所有符合条件的结构简式____________________________________________________________________________________;
(5)已知![]() 。参照上述合成路线,设计一条由苯和乙酸为起始原料制备
。参照上述合成路线,设计一条由苯和乙酸为起始原料制备![]() 的合成路线:____________________________
的合成路线:____________________________
【答案】C10H15NO或C10H15ON 羰基和溴原子 还原反应 ![]()

【解析】
(1)分子式,直接根据结构式可得,B分子官能团有羰基和溴原子,答案为C10H15NO或C10H15ON 羰基和溴原子;
(2)从B到C,再到D,C的分子式没有Br原子,看到D有—NH—CH3,可知B到C的反应中—NH—CH3取代了—Br原子,为取代反应可以写出方程式;而C到D,从分子式看来D比C多了2个H,而且KBH4是一种常见的还原剂,在有机反应类型中加氢去氧为还原。答案为还原反应 ![]() ;
;
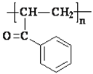
(3)B中溴原子可以发生消去反应,生成碳碳双键,得到产物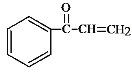 ,再加聚。答案为
,再加聚。答案为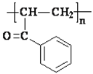 ;
;
(4)能发生银镜反应,有醛基-CHO,再根据核磁共振氢谱中有4组峰比例中有6:2:1:1,6可认为2个—CH3,且处于对称的位置;2在苯环上有两个H处于对称位置。可以写出。答案为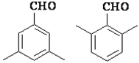 ;
;
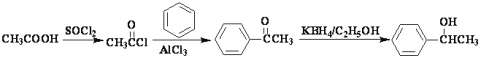
(5)产物![]() 和题中的D很相似,但没有—NH—CH3,可以跳过B到C的步骤,苯环到A需要酰氯,根据产物,酰氯的结构为CH3COCl,根据所以信息,可以用乙酸和SOCl2反应得到。模仿从苯到D的过程,中间跳过B到C的步骤,可得答案为
和题中的D很相似,但没有—NH—CH3,可以跳过B到C的步骤,苯环到A需要酰氯,根据产物,酰氯的结构为CH3COCl,根据所以信息,可以用乙酸和SOCl2反应得到。模仿从苯到D的过程,中间跳过B到C的步骤,可得答案为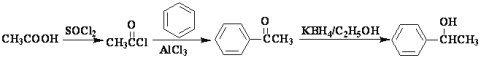 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】在氯氧化法处理CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
⑴某厂废水中含KCN(N为-3价,KOCN也是),其浓度为650mg·L-1。现用氯碱法处理,发生如下反应:KCN+2KOH+Cl2=KOCN+2KCl+H2O,被氧化的元素是_______。
⑵投入过量的液氯,可以将氰酸盐进一步氧化为N2,化学方程式为2KOCN+4KOH+3Cl2=N2↑+2CO2↑+6KCl+2H2O,若处理上述废水20L,使KCN完全转化为无毒物质,计算需要液氯的质量。___________若将所需液氯换成氯气,则所需氯气在标准状况下的体积为多少?______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用胆矾制取氧化铜,并研究氧化铜能否在氯酸钾受热分解实验中起催化作用,实验步骤如下:①称量ag胆矾固体放入烧杯中,加水制成溶液,向其中滴加氢氧化钠溶液至沉淀完全;②过滤步骤①中的混合物,洗涤固体;③将②中的固体转移至蒸发皿中,加热至固体全部变成黑色氧化铜为止,称量所得固体质量为bg;④取一定质量的上述氧化铜固体和一定质量的氯酸钾固体,混合均匀后加热,收集反应生成的氧气(装置如图所示)。请回答下列问题:
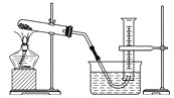
(1)上述各步操作中,需要用到玻璃棒的是________(填写前面所述实验步骤的序号)。
(2)由胆矾制得的氧化铜的产率(实际产量与理论产量的百分比)为________×100%。
(3)为证明氧化铜在氯酸钾的分解反应中起催化作用,在上述实验①~④后还应该进行的实验操作是__________(按实验先后顺序填写字母序号)。
a.过滤 b.烘干 c.溶解 d.洗涤 e.称量
(4)但有很大一部分同学认为,还必须另外再设计一个实验才能证明氧化铜在氯酸钾受热分解的实验中起催化作用。你认为还应该进行的另一个实验是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置制取Cu2O,乙的总反应化学方程式为:2Cu+H2O=Cu2O+H2↑。下列说法正确的是( )
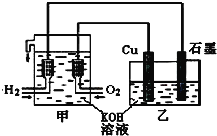
A.乙中Cu电极的电极反应式是:2Cu+2OH--2e-=Cu2O+H2O
B.甲中通入氧气的电极为负极
C.乙中阴离子向石墨电极移动
D.电路上通过0.5mol电子,可制得0.5molCu2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用质量分数为36.5%的浓盐酸(密度为1.25 g·mL-1),配制240 mL 0.1mol·L-1的盐酸,请回答下列问题:
(1)浓盐酸的物质的量浓度为__________。
(2)配制240 mL 0.1 mol·L-1的盐酸,应量取浓盐酸体积__________mL。
(3)应选用容量瓶的规格__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
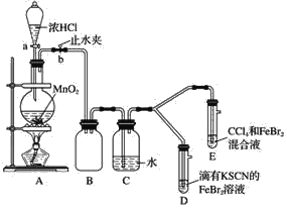
(1)①装置A中发生反应的离子方程式是______________。
②整套实验装置存在一处明显的不足,请指出_______________________。
(2)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。D装置中:红色慢慢褪去。E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:

①用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因___________,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加____________溶液,若溶液颜色________,则上述解释是合理的。
②探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步方程式(离子或化学方程式不限定)解释仅产生白色沉淀原因_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A的结构简式如图所示,下列有关叙述正确的是( )
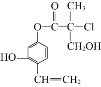
A.1molA最多可以与2molBr2发生反应
B.一个A分子中最多有8个碳原子在同一平面上
C.1molA与足量的NaOH溶液反应,最多可以消耗3molNaOH
D.在一定条件下可以发生消去反应和取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.氮是地球上含量丰富的一种元素,氨、肼(N2H4)、尿素、偏二甲肼(C2H8N2)是氮的常见化合物,在科学技术和生产中有重要的应用。
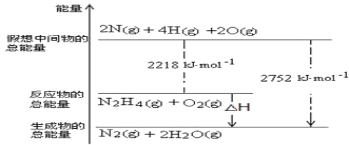
(1)肼(N2H4)是一种高能燃料,写出肼的电子式________,有关化学反应的能量变化如下图所示,已知H2O(g)=H2O(l) ΔH=-44kJ·mol-1,写出肼燃烧的燃烧热的热化学方程式为__________。
(2)火箭使用偏二甲肼(C2H8N2)作燃料,四氧化二氮(N2O4)为氧化剂,燃烧反应放出巨大能量把火箭送入太空,该反应的化学方程式为____________。
II.氨的合成是最重要的化工生产之一。
已知:N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1
在甲、乙、丙三个不同密闭容器中,按不同方式投料,起始温度和容积相同,相关数据如下表所示:
容器 | 甲 | 乙 | 丙 |
相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
反应物投料 | 1molN2、3molH2 | 2molNH3 | 2molNH3 |
平衡时容器体积 | V甲 | V乙 | V丙 |
反应的平衡常数K | K甲 | K乙 | K丙 |
平衡时NH3的浓度/molL-1 | c甲 | c乙 | c丙 |
平衡时NH3的反应速率/molL-1min-1 | υ甲 | υ乙 | υ丙 |
则平衡时容器的体积V甲____________V丙,平衡常数K丙_________K乙(填>、<或=)
III.尿素(H2NCONH2)是一种非常重要的高氮化肥,在工农业生产中有着非常重要的地位。
(1)合成尿素的第一步反应为:2NH3(g)+CO2(g)H2NCOONH4(氨基甲酸铵)(l) △H1 ,若加入恒温、恒容容器中的NH3和CO2的物质的量之比为2:1,能说明反应达到化学平衡状态的是________
a. CO2的浓度不再变化 b. NH3的百分含量不再变化 c. 容器内气体的密度不再变化 d. 混合气体的平均相对分子质量不再变化 e. 2υ(NH3)正=υ (CO2)逆
(2)尿素(NH2CONH2) 燃料电池结构如图所示。其工作时负极电极反应式可表示为:_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.少量金属钠加到冷水中:Na+H2O=Na++OH-+H2↑
B.NaHCO3溶液中滴加少量Ca(OH)2溶液:Ca2++OH-+HCO![]() =CaCO3↓+H2O
=CaCO3↓+H2O
C.NO2与水的反应:3NO2+H2O=2NO![]() +NO+2H+
+NO+2H+
D.用KIO3氧化酸性溶液中的KI:5I-+IO![]() +3H2O=3I2+6OH-
+3H2O=3I2+6OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com