
【题目】25℃时,下列有关电解质溶液的说法正确的是( )
A. 将Na2CO3溶液用水稀释后,pH变大,Kw不变
B. 向有AgCl固体的饱和溶液中加少许水,c(Ag+)和Ksp(AgCl)都不变
C. pH=4.75浓度均为0.1mol/L的CH3COOH、CH3COONa的混合溶液中:c(CH3COO-)+c(OH-)
<c(H+)+c(CH3COOH)
D. 分别用pH=2和pH=3 的 CH3COOH溶液中和等物质的量的NaOH,消耗CH3COOH溶液的体积分别为Va和Vb,则10Va=Vb
【答案】B
【解析】A.将Na2CO3溶液用水稀释后,pH变小,Kw不变,故A错误;B.向有AgCl固体的饱和溶液中加少许水,溶液仍为AgCl的饱和溶液,此时c(Ag+)和Ksp(AgCl)都不变,故B正确;C.pH=4.75、浓度均为0.1molL-1的CH3COOH和CH3COONa的混合溶液中存在电荷守恒,c(CH3COO-)+c(OH-)=c(Na+)+c(H+),中醋酸电离程度大于醋酸根离子水解程度,溶液呈酸性,醋酸是弱电解质,溶液中c(CH3COOH)<c(Na+),c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+),故C错误;D.含等物质的量NaOH的溶液分别用pH为2和3的CH3COOH溶液中和,则有二者物质的量相等,因为所中和的氢氧化钠的物质的量是一定的,而醋酸是弱酸,醋酸为弱电解质,浓度越大,电离程度越小,pH为2和3的CH3COOH溶液,后者电离程度大,pH为2的CH3COOH的浓度大于pH为3的CH3COOH溶液的浓度的10倍,设pH为2的醋酸浓度为x,PH=3的醋酸浓度为y,则有Va×x=Vb×y,则![]() ,即Vb>10Va,故D错误;答案为B。
,即Vb>10Va,故D错误;答案为B。


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】关于晶体的下列说法正确的是( )
A. 六方最密堆积的空间利用率是52%
B. 离子晶体中一定含金属阳离子
C. 在共价化合物分子中各原子都形成8电子结构
D. 分子晶体的熔点不一定比金属晶体的熔点低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸是一种重要的化工原料,工业上生产硝酸的主要过程中:(1)反应N2(g)+3H2(g)![]() 2NH3(g)△H<0 ;恒温时,将N2和H2的混合气体充入2L密闭容器中,10分钟后反应达到平衡下列图像能正确表示该过程中相关量的变化的是__________。(选填字母)。
2NH3(g)△H<0 ;恒温时,将N2和H2的混合气体充入2L密闭容器中,10分钟后反应达到平衡下列图像能正确表示该过程中相关量的变化的是__________。(选填字母)。

(2)一定温度下,在密闭容器中充入1molN2和3molH2发生反应。若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的7/10,则N2的转化率a1=________;
若向该容器中再加入1molN2和3molH2,达到平衡状态时,N2的转化率为a2,则a2________a1(填“>”、“<”或“=”)。
(3)2NO(g)+O2(g)![]() 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如图)。

①比较P1、P2的大小关系:P1____P2(填“>”、“<”或“=”)。
②随温度升高,该反应平衡常数变化的趋势是__________。
(4)硝酸厂常用如下2种方法处理尾气。
①催化还原法:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol
N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是________________________________。
②碱液吸收法:用Na2CO3溶液吸收NO2生成CO2。若每4.6gNO2和Na2CO3溶液反应时转移电子数为0.05mol,则反应的离子方程式是___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 乙二醇和丙三醇互为同系物
B. 甲烷、乙烯和苯在工业上都可通过石油分馏得到
C. 可通过酸性高锰酸钾溶液来区别烯烃和炔烃
D. 苯酚对皮肤有腐蚀性,如果不慎粘到手上,应该立即用酒精清洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组欲利用CuO与氨反应,研究氨的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
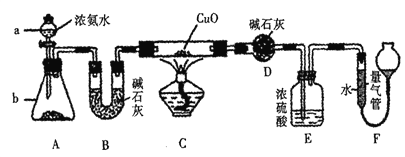
(1)仪器a的名称为 _________。
(2)实验室中,利用装置A,还可制取的无色气体是_________(填字母)。
A.Cl2 B.04 C.C02 D.N02
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管内有无色无味的气体生成,上述现象证明氨气具有________性,写出相应的化学方程式 __________。
(4) D装置的作用是 __________。
(5) E装置中浓硫酸的作用是__________。
(6)读取气体体积前,应对装置F进行的操作是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. NaCl晶体属于离子晶体,熔化时离子键被削弱
B. CO2晶体属于分子晶体,汽化时需克服分子间作用力
C. SiO2晶体属于原子晶体,熔化时需破坏共价键
D. C60晶体与金刚石均属于原子晶体,其晶体熔点高、硬度大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】糖类、油脂、蛋白质是人体重要的能源物质,请根据它们的性质回答以下问题:
(1)油脂在酸性和碱性条件下水解的共同产物是__________(写名称)。
(2)蛋白质的水解产物具有的官能团是____________________(写结构简式)。
已知A是人体能消化的一种天然高分子化合物,B和C分别是A在不同条件下的水解产物,它们有如下转化关系,请根据该信息完成(3)~(4)小题。

(3)1molB完全氧化时可以放出2804kJ的热量,请写出其氧化的热化学方程式___________________。
(4)请设计实验证明A通过反应①已经全部水解,写出操作方法、现象和结论:____________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com