
(14分)下图表示有关物质之间的转化关系,其中A、B均为无色盐溶液,B的焰色反应呈黄色,F是形成酸雨的污染物之一,H难溶于水且不溶于稀盐酸。(部分产物略去)
(1)A、B、E、F代表的物质分别为 、 、 、 (填化学式);
(2)反应①的离子反应方程式为 ;
(3)若E与F的物质的量之比为n(E) : n(F)>1:1,则在混合溶液G中滴入几滴石蕊
: n(F)>1:1,则在混合溶液G中滴入几滴石蕊
试液,可观察到的现象为 ;
(4)若E与F的物质的量之比1:1,则③中发生的离子反应方程式为
;
(5)④中发生的反应离子方程式为 。
科目:高中化学 来源: 题型:
(14分)Cu2S是火法炼铜一种重要的原料,下面是由Cu2S冶炼铜及制取CuSO4·5H2O的流程图:
⑴Cu2S中铜元素的化合价为 ,火法炼铜的反应原理是 (用化学方程式表示)。
⑵Cu2O,CuO加入足量稀硫酸得到的体系A中看到溶液呈蓝色,且有红色物质生成,
请写出生成红色物质的离子方程式: 。
⑶若将A中单质反应,操作加入试剂最好是 。
A. 加入适量的NaNO3 B. 适量的 HNO3 C. 适量的H2O2
⑷若B溶液的体积为0.2L,电解B溶液一段时间后溶液的pH值由2变为1(体积变化忽略不计),此时电解过程中转移电子数的物质的量是 。
⑸取5.0 g胆矾样品逐渐升高温度使其分解,分解过程的热重曲线如下图所示:通过计算确定258℃时发生反应的化学方程式 ,e点的化学式 (计算过程略去)。
查看答案和解析>>
科目:高中化学 来源:2013届江苏省兴化市板桥高级中学高三9月双休检测化学试卷(带解析) 题型:实验题
(14分)某同学帮助水质检测站配制960mL 1 mol·L-1NaOH溶液以备使用。
(1)该同学应选择________mL的容量瓶。
(2)其操作步骤如下图所示,则如图操作应在下图中的________(填选项字母)之间。

A.②与③ B.①与② C.④与⑤
(3)该同学应称取NaOH固体________g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小________(填字母),并在下图中选出能正确表示游码位置的选项________(填字母)。
附表 砝码规格
| | a | b | c | d | e |
| 砝码大小/g | 100 | 50 | 20 | 10 | 5 |

查看答案和解析>>
科目:高中化学 来源:2013届吉林省长春市实验中学高三上学期第一次月考化学试卷(带解析) 题型:填空题
(14分) 卤化物和卤酸盐在工业生产中有着重要的作用。某小组为探究其中一些盐的性质,查阅资料并进行实验。查阅资料如下:
① BrO3- + 6I- + 6H+ = 3I2 + Br-+ 3H2O ② 2BrO3- + I2 = 2IO3- + Br2
③ IO3- + 5I- + 6H+ = 3I2 + 3H2O ④ 2IO3- + 10Br-+ 12H+ = I2 + 5Br2 + 6H2O
实验如下:
| 步骤 | 现象 |
| ⅰ.向盛有30 mL 0.2 mol·L-1 KI溶液的锥形瓶中依次滴入几滴淀粉溶液和足量稀硫酸,再用滴定管逐滴加入KBrO3溶液 | 随着KBrO3溶液滴入,溶液由无色变为蓝色并逐渐加深,最终保持不变 |
| ⅱ.继续向上述溶液中滴入KBrO3溶液 | 溶液的蓝色逐渐褪去 |
查看答案和解析>>
科目:高中化学 来源:2012届吉林省长春市高三第一次调研测试化学试卷 题型:填空题
(14分)Cu2S是火法炼铜一种重要的原料,下面是由Cu2S冶炼铜及制取CuSO4·5H2O的流程图:
⑴Cu2S中铜元素的化合价为 ,火法炼铜的反应原理是 (用化学方程式表示)。
⑵Cu2O,CuO加入足量稀硫酸得到的体系A中看到溶液呈蓝色,且有红色物质生成,
请写出生成红色物质的离子方程式: 。
⑶若将A中单质反应,操作加入试剂最好是 。
A. 加入适量的NaNO3 B. 适量的 HNO3 C. 适量的H2O2
⑷若B溶液的体积为0.2L,电解B溶液一段时间后溶液的pH值由2变为1(体积变化忽略不计),此时电解过程中转移电子数的物质的量是 。
⑸取5.0 g胆矾样品逐渐升高温度使其分解,分解过程的热重曲线如下图所示:通过计算确定258℃时发生反应的化学方程式 ,e点的化学式 (计算过程略去)。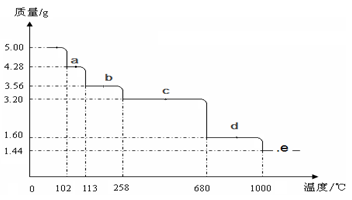
查看答案和解析>>
科目:高中化学 来源:2013届年天津市等三校高二上学期期末联考化学试卷 题型:填空题
(共14分)实现 “节能减排” 和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
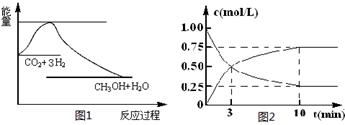
(1)关于该反应的下列说法中,正确的是____________(填字母)。
A.DH>0,DS>0 B.DH>0,DS<0 C.DH<0,DS<0 D.DH<0,DS>0
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
①从反应开始到平衡,CH3OH的平均反应速率v(CH3OH) = mol·(L·min)-1;
H2的转化率w(H2) =
②该反应的平衡常数表达式K=
③下列措施中能使化学平衡向正反应方向移动的是 (填字母)。
A.升高温度 B.将CH3OH(g)及时液化抽出
C.选择高效催化剂 D.再充入l molCO2和3 molH2
(3)25℃,1.01×105Pa时,16g 液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出表示CH3OH燃烧热的热化学方程式:
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此电池的负极电极反应式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com