
【题目】化学计盘在化学中占有重要地位,请回答下列问题。
(1)相同质量的SO2和SO3所含氧原子的个数比为______。
(2)质量相同的A、B两种气体,在同温同压下,A的分子数比B多,则A的密度_____ B的密度(填>、=、<)。
(3)焦亚硫酸纳(Na2 S2O5)是常用食品抗氧化剂,常用于葡萄酒、果脯等食品中。果脯中的Na2 S2O5的使用量是以游离的SO2来计算的,我国规定每千克果脯中SO2的最高含量是0.35g。
①下列试剂可用于检测SO2的是_________。
A.I2 B.HC1 C. H2SO4 D.CS2
②某500g果脯样品经检测得知含有SO2的物质的量为0.005 mol,该产品是否合格_________ (填“是”或“否”)。
(4)“84消毒液”是常用的含氯消毒剂,可以利用Cl2与NaOH反应制得该产品。反应的离子方程式为_______。“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84gcm-3)的浓硫酸配制1 000 mL 0.50 mol L-1的稀硫酸用于增强“84消毒液”的消毒能力。需用量筒量取浓硫酸的体积为_________mL。
【答案】5:6 ![]()
![]() 否
否 ![]()
![]()
【解析】
(1)同质量比较原子个数,可以找二者相对原子质量的最小公倍数,也可假设等质量为1进行计算;阿伏加德罗定律的应用一定要会进行公式的转换,找准正比、反比关系; (2)理想状态气体方程:![]() ,该题要比较分子数与密度,所以变形为:
,该题要比较分子数与密度,所以变形为:![]() ,同质量、同温度、同压强下,分子数与密度成反比;(3)要检测SO2,即能与SO2发生反应,SO2既有还原性也有氧化性;(4)稀释浓溶液,抓住反应前后溶质的物质的量不变进行计算
,同质量、同温度、同压强下,分子数与密度成反比;(3)要检测SO2,即能与SO2发生反应,SO2既有还原性也有氧化性;(4)稀释浓溶液,抓住反应前后溶质的物质的量不变进行计算![]() 。
。
(1)同质量的SO2、SO3假设其质量均为1g,则二氧化硫的物质的量为![]() ,三氧化硫的物质的量为
,三氧化硫的物质的量为![]() ,氧原子的个数比:
,氧原子的个数比:![]() :
:![]() ,约分化简为5:6;
,约分化简为5:6;
故答案为:5:6;
(2)理想状态气体方程:![]() ,该题要比较分子数与密度,所以变形为:
,该题要比较分子数与密度,所以变形为:![]() ,同质量、同温度、同压强下,分子数与密度成反比,A的分子数比B多,所以A的密度小于B的密度;
,同质量、同温度、同压强下,分子数与密度成反比,A的分子数比B多,所以A的密度小于B的密度;
故答案为:<;
(3) ①要检测SO2,即能与SO2发生反应,SO2有强还原性,所以可以和I2(做氧化剂)发生氧化还原反应,其他均不反应,故选A;②![]() 的SO2的质量为:
的SO2的质量为:![]() ,则500g的果脯中含SO2
,则500g的果脯中含SO2![]() ;
;
故答案为:A;否;
(4)氯气与氢氧化钠反应的离子方程式:![]() ;稀释浓溶液,根据反应前后溶质的物质的量不变进行计算
;稀释浓溶液,根据反应前后溶质的物质的量不变进行计算![]() ,浓溶液的浓度
,浓溶液的浓度![]() ,则
,则![]() ;
;
故答案为:![]() ;
;![]() 。
。


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
【题目】四种短周期主族元素 X、Y、Z、W 的相对位置如表,元素 X 的原子核外电子数是 Z的 2 倍。下列说法不正确的是
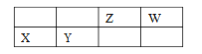
A. W 元素的简单气态氢化物的热稳定性比 Z 元素的简 单气态氢化物的高
B. 气体分子(ZW)2 的结构式为 N≡C—C≡N
C. X、Y、W 三种元素的简单离子半径最大的是 Y
D. 元素 X 位于周期表中第三周期、第ⅡA族,其单质制备可用电解熔融 XCl2 的方法。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.回答下列问题:
(1)烃A的结构简式为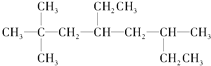 ,用系统命名法命名烃A:____________。
,用系统命名法命名烃A:____________。
(2)某烃的分子式为![]() ,核磁共振氢谱图中显示4个峰,则该烃的一氯代物有_______种,该烃的结构简式为____________。
,核磁共振氢谱图中显示4个峰,则该烃的一氯代物有_______种,该烃的结构简式为____________。
(3)麻黄素又称黄碱,是我国特定中药材麻黄中所含有的一种生物碱。经科学家研究发现其结构为: ,下列各物质:A.
,下列各物质:A. 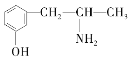 B.
B. ![]() C.
C. 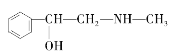 D.
D. 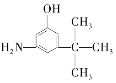 E.
E. 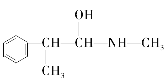
与麻黄素互为同分异构体的是_________(填字母,下同),互为同系物的是___________(填字母)。
Ⅱ.有机物C常用于食品行业。已知![]() 在足量
在足量![]() 中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重
中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重![]() 和
和![]() ,经检验剩余气体为
,经检验剩余气体为![]() 。
。
(1)C分子的质谱图如图所示,从图中可知其相对分子质量是________,则C的分子式是_______。
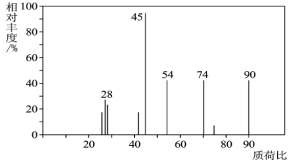
(2)C能与![]() 溶液发生反应,C一定含有的官能团是_____________。
溶液发生反应,C一定含有的官能团是_____________。
(3)C分子的核磁共振氢谱有4个峰,峰面积之比是![]() ,则C的结构简式是________。
,则C的结构简式是________。
(4)![]() 与
与![]() 的氢氧化钠溶液反应,需溶液的体积是_____
的氢氧化钠溶液反应,需溶液的体积是_____![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.小苏打用于治疗胃酸过多:NaHCO3+H+=Na++CO2↑+H2O
B.铜与浓硝酸反应:Cu+3HNO3(浓)=Cu2++2NO3-+2NO2↑+2H2O
C.用FeCl3溶液腐蚀印刷电路板:2Fe3++Cu=Cu2++2Fe2+
D.向漂白液中通入SO2提高漂白效率:ClO-+SO2+H2O=HClO+HSO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了防止枪支生锈,常采用化学处理使枪支的钢铁零件表面生成Fe3O4的致密保护层— “发蓝”。化学处理过程中,其中一步反应为3Fe + NaNO2+5NaOH =3Na2FeO2+H2O+NH3↑。下列叙述不正确的是
A.该处理过程不会产生污染B.上述反应中铁被氧化
C.NO2-的氧化性大于FeO22-D.反应中转移2mole-,生成还原产物![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁在人体中不是以游离态的形式存在,而是以Fe2+和Fe3+形式存在。Fe2+易被吸收,给贫血者补充铁时,应给予含Fe2+的盐。服用维生素C,有利于人体对铁元素的吸收。
(1)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作 用下转化成亚铁盐。此反应的离子方程式______。
(2)工业盐的主要成分是NaNO2,曾多次发生过因误食NaNO2而中毒的事件,其原因是NaNO2把人体内的Fe2+转化为Fe3+而失去与O2结合的能力,这说明NaNO2具有________性。
(3)“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
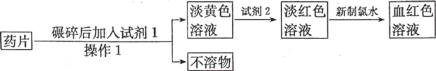
①操作1的名称是__________。
②试剂2为______溶液(填化学式)。
③加入新制氯水,溶液中发生反应的离子方程式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)![]() 3C(g)+4D(g)反应中,表示该反应速率最快的是( )
3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A. v(B)=0.3mol/(L· s) B. v(A)=0.5mol/(L· min)
C. v(C)=0.8mol/(L· s) D. v(D)=1mol/(L· min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在可逆反应2A(g)+3B(g)![]() xC(g)+D(g)中,已知:反应开始加入的物质只有 A、B,起始浓度 A 为 5 mol·L-1,B 为 3 mol·L-1,前 2 min C 的平均反应速率为 0.5 mol·L-1·min-1,2 min 后,测得 D 的浓度为 0.5mol·L-1,则关于此反应的下列说法中正确的是( )
xC(g)+D(g)中,已知:反应开始加入的物质只有 A、B,起始浓度 A 为 5 mol·L-1,B 为 3 mol·L-1,前 2 min C 的平均反应速率为 0.5 mol·L-1·min-1,2 min 后,测得 D 的浓度为 0.5mol·L-1,则关于此反应的下列说法中正确的是( )
A.2 min 末时 A 和 B 的浓度之比为 5∶3
B.x=1
C.2 min 末时 A 消耗的浓度为 0.5 mol·L-1
D.2 min 末时 B 的浓度为 1.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究金属与硝酸的反应,实验如下。
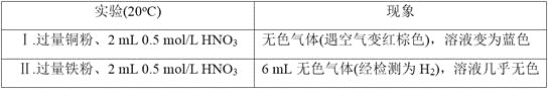
(1)Ⅰ中的无色气体是_________。
(2)Ⅱ中生成H2的离子方程式是______________________________________。
(3)研究Ⅱ中的氧化剂
①甲同学认为该浓度的硝酸中H+的氧化性大于NO3-,所以NO3-没有发生反应。乙同学依据Ⅰ和Ⅱ证明了甲的说法不正确,其实验证据是_______________________________。
②乙同学通过分析,推测出NO3-也能被还原,依据是___________________________,进而他通过实验证实该溶液中含有NH4+,其实验操作是__________________________
(4)根据实验,金属与硝酸反应时,影响硝酸还原产物不同的因素有_________________________试推测还可能有哪些因素影响_________(列举1条)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com