
| A、在100℃、101kPa条件下,液态水的气化热为40.69kJ?mol-1,则H2O(g)?H2O(l)的△H=40.69kJ?mol-1 |
| B、在PH=2的盐酸中,水电离出来的c(OH-)=1.0×10-12mol?L-1 |
| C、CO(g)的燃烧热是283.0kJ?mol-1,则2CO2(g)═2CO(g)+O2(g)的△H=2×(-283.0)kJ?mol-1 |
| D、常温下,在0.10mol?L-1的NH3?H2O溶液中加入少量NH4Cl晶体,能使NH3?H2O的电离度降低,溶液的pH减小 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、CH2=CH2 |
| B、CH2=C(CH3)-CH3 |
| C、CH≡CH |
| D、CH≡C-CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、达到平衡时X浓度为0.04 mol/L |
| B、将容器体积变为20L,Z的平衡浓度变为0.015mol/L |
| C、若增大压强,平衡向正反应方向移动,平衡常数变大 |
| D、若升高温度,X的体积分数增大,则该反应的△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某无色溶液中可能含有下列离子:H+、Cl-、Na+、Fe2+ |
| B、能使石蕊变红的溶液中可能含有Cl-、K+、Na+、NO3- |
| C、取少量某溶液,向其中加入盐酸酸化的BaCl2溶液,通过观察是否有白色沉淀生成,可证明该溶液中是否含有SO42- |
| D、H++OH-═H2O可描述所有酸碱中和反应的实质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H+.CO32-.NO3-.SO42- |
| B、Ba2+.Cl-.NO3-.CO32- |
| C、Cu2+.H+.SO42-.Cl- |
| D、Ag+.OH-.CO32-.H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
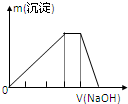 某盐A是含有两种阳离子的硫酸盐,将该溶液溶于水,向溶液中滴加NaOH溶液生成沉淀的物质的量与NaOH体积关系如图所示,下列离子溶液中能大量共存,加入晶体A后仍能大量共存的是( )
某盐A是含有两种阳离子的硫酸盐,将该溶液溶于水,向溶液中滴加NaOH溶液生成沉淀的物质的量与NaOH体积关系如图所示,下列离子溶液中能大量共存,加入晶体A后仍能大量共存的是( )| A、Na+、H+、Cl-、NO3- |
| B、K+、Ba2+、OH-、I- |
| C、Mg2+、Fe3+、Br-、HCO3- |
| D、Na+、Mg2+、Cl-、AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com