
| A、达到平衡时X浓度为0.04 mol/L |
| B、将容器体积变为20L,Z的平衡浓度变为0.015mol/L |
| C、若增大压强,平衡向正反应方向移动,平衡常数变大 |
| D、若升高温度,X的体积分数增大,则该反应的△H<0 |
| (1-0.6)mol |
| 10L |
| 1 |
| 2 |
| 1 |
| 2 |


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
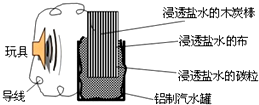 利用生活中常见的材料可以进行很多科学实验,甚至制作出一些有实际应用价值的装置,如图就是用一个废旧材料制作的可用于驱动玩具电池的示意图.该电池工作时有关说法正确的是( )
利用生活中常见的材料可以进行很多科学实验,甚至制作出一些有实际应用价值的装置,如图就是用一个废旧材料制作的可用于驱动玩具电池的示意图.该电池工作时有关说法正确的是( )| A、铝罐将逐渐被腐蚀 |
| B、该装置实现了化学能向电能的转化 |
| C、炭棒应与玩具电机的负极相连 |
| D、该电池工作一段时间后炭棒和炭粒的质量会减轻 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2NaBr+Cl2═2NaCl+Br2 | ||||
B、2KMnO4
| ||||
| C、2H2S+SO2═3S↓+2H2O | ||||
| D、2FeCl3+H2S═2FeCl2+S↓+2HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 充电 |
| 放电 |
| A、放电时,负极上发生反应的物质是NiO2 |
| B、放电时,正极反应是:NiO2+2e-+2H+=Ni(OH)2 |
| C、充电时,阴极反应是:Ni(OH)2-2e-+2OH-=NiO2+2H2O |
| D、充电时,阳极附近pH值减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在100℃、101kPa条件下,液态水的气化热为40.69kJ?mol-1,则H2O(g)?H2O(l)的△H=40.69kJ?mol-1 |
| B、在PH=2的盐酸中,水电离出来的c(OH-)=1.0×10-12mol?L-1 |
| C、CO(g)的燃烧热是283.0kJ?mol-1,则2CO2(g)═2CO(g)+O2(g)的△H=2×(-283.0)kJ?mol-1 |
| D、常温下,在0.10mol?L-1的NH3?H2O溶液中加入少量NH4Cl晶体,能使NH3?H2O的电离度降低,溶液的pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1molFe和足量浓硝酸反应后,转移电子数目为0.3NA |
| B、标准状况下,1 molHF分子体积约为22.4 L |
| C、1molCl2参加化学反应,一定转移2mol电子 |
| D、11g 2D218O中含有的氢氧键数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com