
����Ŀ����һ�ݻ�Ϊ2L���ܱ������ڼ���0.2mol��N2��0.6mol��H2 �� ��һ�������·������·�Ӧ��N2��g��+3H2��g��2NH3��g ����H��0����Ӧ��NH3�����ʵ���Ũ�ȵı仯�������ͼ�� 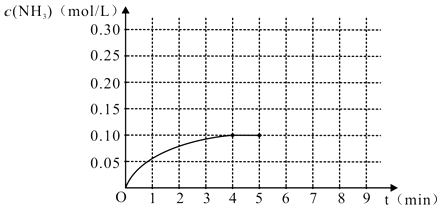
��1��������ͼ������ӷ�Ӧ��ʼ��ƽ��ʱ��ƽ����Ӧ����v��NH3��Ϊ ��
��2����Ӧ�ﵽƽ���5����ĩ�����������������䣬���ı䷴Ӧ�¶ȣ���NH3�����ʵ���Ũ�Ȳ�����Ϊ ��
A.0.20mol/L
B.0.12mol/L
C.0.10mol/L
D.0.08mol/L
��3����Ӧ�ﵽƽ���5����ĩ�����������������䣬��ֻ�������������Сһ�룬ƽ���ƶ�������淴Ӧ������������Ӧ��������
���𰸡�
��1��0.025mol/��L?min��
��2��AC
��3������Ӧ����
���������⣺��1����ͼ��֪��4min�ﵽƽ�⣬0��4min���ɰ���Ϊ0.10mol/L��ƽ����Ӧ����v��NH3��= ![]() =0.025 mol/��Lmin����
=0.025 mol/��Lmin����
���Դ��ǣ�0.025 mol/��Lmin������2����ƽ�������Ũ��Ϊ0.10mol/L����5����ĩ�����������������䣬�÷�ӦΪ���ȷ�Ӧ��
�������¶ȣ�ƽ�������ƶ���������Ũ������Ϊ���淴Ӧ��������ȫת������֪0.10mol/L��c��NH3����0.2mol/L��
�������¶ȣ�ƽ�������ƶ���������Ũ�ȼ�С����֪0��c��NH3����0.1mol/L��
��NH3�����ʵ���Ũ�Ȳ�����Ϊ0.2mol/L��0.1mol/L��
���Դ��ǣ�AC����3��ƽ����������������䣬��ֻ�������������Сһ�룬��ѹǿ���÷�ӦΪ���������С�ķ�Ӧ����֪ѹǿ����ƽ��������Ӧ�����ƶ���
���Դ��ǣ�����Ӧ����
�����㾫�������ջ�ѧƽ��״̬���ʼ������ǽ����ĸ�������Ҫ֪����ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч����


 ��������ϵ�д�
��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧΪ̽��Ԫ�����ڱ���Ԫ�����ʵĵݱ���ɣ����������ϵ��ʵ�飺
����̽��ͬ����Ԫ�����ʵĵݱ����
��1����ͬ�����£����ơ�þ������1 mol�ֱ�Ͷ�뵽������ͬŨ�ȵ�ϡ�����У���Ԥ��ʵ������_______��ϡ���ᷴӦ����ң�______��ϡ���ᷴӦ������������ࡣ
��2����Na2S��Һ��ͨ���������ֻ�ɫ���ǣ���֤��Cl�ķǽ����Ա�Sǿ����Ӧ�����ӷ���ʽΪ_____________________________��
����̽��ͬ����Ԫ�طǽ����Եĵݱ����
ij�о���ѧϰС�������һ��ʵ����̽����A��Ԫ��ԭ�ӵĵõ�������ǿ�����ɡ���ͼ��A��B��C�������ɹ�ѡ����ȡ������װ�ã�װ��D�IJ������Т����ڴ����η���պ��NaBr��Һ��NaOHŨ��Һ������
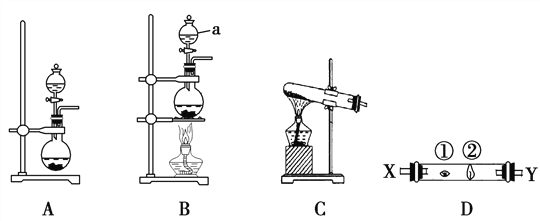
��3��д��װ��B������a������ ________________��
��4��ʵ������ȡ�������ɲ�������ԭ����2KMnO4��16HCl(Ũ)===2KCl��2MnCl2��5Cl2����8H2O�����ݸ÷�Ӧԭ��ѡ��_____________���A������B����C����װ����ȡ������
��5����Ӧװ�õĵ���������װ��D��X���ܣ��Իش��������⣺
�ٴ�������Ӧ�����ӷ���ʽΪ________________________________��
�ڴ�������Ӧ�����ӷ���ʽΪ________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��֤����ʵ�����Ʊ��õ���Cl2�л����HCl����ͬѧ�������ͼ��ʾ��ʵ��װ�ã���Ҫ��ش��������⡣
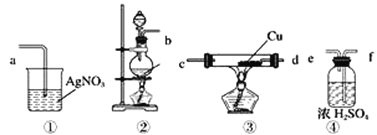
��1������ݼ�ͬѧ��ʾ��ͼ������ʵ��װ�ô������ҵ�����˳��װ�âڡ�__��
��2��ʵ�����Ʊ�Cl2�����ӷ���ʽΪ__��
��3��װ�â���Cu������__ ���û�ѧ����ʽ��ʾ����
��4����ͬѧ��Ϊ��ͬѧʵ�������Ȼ����ȱ�ݣ�����֤������ͨ��AgNO3��Һ�е�����ֻ��һ�֡�Ϊ�ˣ���ͬѧ�������ͨ��װ�â�֮ǰ��Ҫ��װһ������װ�âݣ���֤������ͨ��AgNO3��Һ�е�����ֻ��һ�֡�����Ϊװ�â�Ӧ����__��
��5����ͬѧ������ͬѧ��Ƶ�װ�ú����������װ�ã�ֻ�轫ԭ���ձ��е�AgNO3��Һ������ɫʯ����Һ������۲쵽_____��������֤����Cl2ʱ��HCl�ӷ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ֶ���������Ԫ��X��Y��Z��W�����λ�������Ԫ��X��ԭ�Ӻ����������Z��2��������˵������ȷ����
![]()
A. WԪ�صļ���̬�⻯������ȶ��Ա�ZԪ�صļ���̬�⻯��ĸ�
B. �������(ZW)2�ĽṹʽΪN��C��C��N
C. X��Y��W����Ԫ�صļ����Ӱ뾶������Y
D. Ԫ��X����Ԫ��W������ȼ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ʵ�����Ϊ3.00mol����A��B�����5L�����У��������·�Ӧ��3A+B2C���ڷ�Ӧ������C�����ʵ����������¶ȱ仯��ͼ��ʾ�� 
��1��T0��Ӧ�ķ�Ӧ����v������v���棩���á�=����������������ʾ����ͬ����
��2���˷�Ӧ������ӦΪ�ȣ�����š���������
��3��X��Y����A��������Ӧ���ʵĴ�С��ϵ��YX��
��4���¶�T��T0ʱ��C%�������ԭ���ǣ���
��5����Y���C�����ʵ�������Ϊ25%����μӷ�Ӧ��A���ʵ���Ϊmol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й����ʵ���������;���ж�Ӧ��ϵ����
A.NH4Cl��Һ�����ԣ�������ȥ������
B.SO2���л�ԭ�ԣ�������Ư��ֽ��
C.Al2O3��������������������²���
D.Na2SiO3��Һ�ʼ��ԣ�������ľ�ķ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ����Ҫ�Ļ���ԭ�ϣ��Ա���Ϊ��Ҫ��ʼԭ�ϣ������з�Ӧ���Ƶ�����M�߷��ӻ�����N�������ֲ��P��Ӧ��������ȥ��
��1���ɱ�������A�Ļ�ѧ����ʽ�� ��
��2����֪C�ķ���ʽΪC5H12O��C�������Na��Ӧ��C��һ�ȴ�����2�֣���C������ͬ�����ŵ�ͬ���칹�����֣�C�Ľṹ��ʽ����
��3��B��C��Ӧ�Ļ�ѧ����ʽ�� ��
��4���ɱ�������D�Ļ�ѧ����ʽ����D����N�ķ�Ӧ������
��5���Ա���Ϊ����ԭ��Ҳ���Ժϳɷ�����F����������F����Է�������Ϊ152��������Ԫ�ص���������Ϊ31%��F��ȫȼ��ֻ����CO2��H2O����F�ķ���ʽ�� �� ��֪���ٷ����廯����F����NaHCO3��Һ��Ӧ���Ҳ��ܷ���ˮ�ⷴӦ��
��F�ĺ˴Ź���������ʾ������к���4����ԭ�ӣ�
�۷��ӽṹ�в����ڡ���O��O���������ӷ�ʽ��F�Ľṹ��ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴Ӧ2A��g��+3B��g��4C��g��+D��g������֪��ʼŨ��c��A��=4molmol��1 �� c��B��=3molmol��1 �� C��DŨ�Ⱦ�����0����Ӧ��ʼ2���ﵽƽ��״̬����ʱD��ƽ��Ũ��Ϊ0.5molL��1 �� ������˵������ȷ���ǣ� ��
A.��Ӧ����v��C��=1molL��1s��1
B.C��ƽ��Ũ��Ϊ4 molL��1
C.A��ת����Ϊ25%
D.B��ƽ��Ũ��Ϊ1.5 molL��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֤ʳƷ��ȫ������Ӫ�����⣬�DZ������彡���Ļ�����
��ά����C�ܴٽ������������������и���ά����C����������ĸ����
A��ţ�� B������ C������
��ȱ��ij����Ԫ�ؽ����¼�״���״����������������Ԫ����
A���� B���� C����
��ʹ����ù�ؿ��ܻ��������������ҩǰ����һ��Ҫ���� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com