
乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:
2CO(g) + 4H2(g)  CH3CH2OH(g) + H2O(g)
△H = —256.1 kJ·mol-1
CH3CH2OH(g) + H2O(g)
△H = —256.1 kJ·mol-1
已知:CO(g) + H2O(g)  CO2(g)+H2(g)
△H= —41.2 kJ·mol-1
CO2(g)+H2(g)
△H= —41.2 kJ·mol-1
(1)以CO2(g)与H2(g)为原料也可合成乙醇,其热化学方程式如下:
2CO2(g) +6H2(g)  CH3CH2OH(g) +3H2O(g)
△H = 。
CH3CH2OH(g) +3H2O(g)
△H = 。
(2)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。
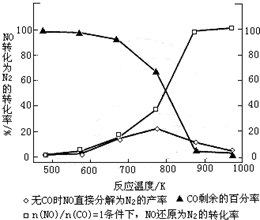
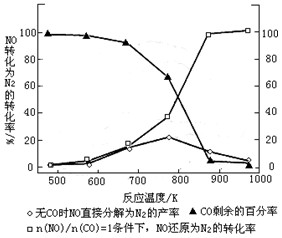
①某研究小组在实验室以Ag– ZSM– 5为催化剂,测得NO转化为N2的转化率随温度变化情况如下图。若不使用CO,温度超过800℃,发现NO的转化率降低,其可能的原因为 ;在n(NO)/n(C O)=1的条件下,应控制的最佳温度在 左右。

②用活性炭还原法处理氮氧化物。有关反应为:C (s) +2NO2(g)
 N2 (g) + CO2
(g)。某研究小组向某密闭容器中加人足量的活性炭和NO,恒温( T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2 (g) + CO2
(g)。某研究小组向某密闭容器中加人足量的活性炭和NO,恒温( T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
|
浓度/mol∙L-1 时间/min |
NO |
N2 |
CO2 |
|
0 |
1.00 |
0 |
0 |
|
20 |
0.40 |
0.30 |
0.30 |
|
30 |
0.40 |
0.30 |
0.30 |
|
40 |
0.32 |
0.34 |
0.17 |
|
50 |
0.32 |
0.34 |
0.17 |
I.根据表中数据,求反应开始至20min以v(NO)表示的反应速率为 (保留两位有效数字),T1℃时该反应的平衡常数为 (保留两位有效数字)。
II.30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是 。下图表示CO2的逆反应速率[v逆(CO2)]随反应时间的变化关系图。请在图中画出在30min改变上述条件时,在40min时刻再次达到平衡的变化曲线。

(17分)
(1)—173.7kJ•mol-1(3分)
(2)①该反应是放热反应,升高温度反应更有利于向逆反应方向进行(2分)
900℃(2分)
②I.0.030mol•L-1•mol-1(3分,没写单位扣1分)
0.56(3分)
II.减小CO2的浓度(2分)
 (2分)
(2分)
作图要点:起点在30min时v逆(CO2)的一半以下;终点不超过30min时v逆(CO2)
【解析】
试题分析:(1)将题目中出现的三个热化学方程式依次编号为①②③,观察可得①—②×2=③,根据盖斯定律可知,③的焓变=①的焓变—②的焓变×2=—173.7kJ•mol-1;(2)①若不使用CO,则反应为2NO(g) N2(g)+O2(g),随着温度的升高,反应速率增大,从开始反应到达到平衡时,NO转化为N2的转化率随温度升高而逐渐增大,达到平衡后,再升高温度,NO的转化率随温度升高逐渐减小,说明正反应是放热反应,升高温度使平衡左移;有CO时,发生的不可逆反应为CO+NO
N2(g)+O2(g),随着温度的升高,反应速率增大,从开始反应到达到平衡时,NO转化为N2的转化率随温度升高而逐渐增大,达到平衡后,再升高温度,NO的转化率随温度升高逐渐减小,说明正反应是放热反应,升高温度使平衡左移;有CO时,发生的不可逆反应为CO+NO N2+CO2,NO的转化率随温度的升高而逐渐增大,但是900℃→1000℃时NO的转化率增大程度不大,但是生产成本却会明显增加,因此在n(NO)/n(C
O)=1的条件下,应控制的最佳温度为900℃;②I.读表中信息可得,从反应开始到20min,NO的变化浓度=(1.00—0.40) mol∙L-1=0.60 mol∙L-1,根据平均反应速率的定义式可知,v(NO)=△c/△t=0.030mol•L-1•mol-1;由于固体物质浓度是常数,不需要写入平衡常数表达式,读表中信息可知,20min时该反应在T1℃时达到平衡,则K=[c(CO2)•c(N2)]/c2(NO2)=[0.30×0.30]/0.402≈0.56;II.30min改变条件后,根据三行数据法可知:
N2+CO2,NO的转化率随温度的升高而逐渐增大,但是900℃→1000℃时NO的转化率增大程度不大,但是生产成本却会明显增加,因此在n(NO)/n(C
O)=1的条件下,应控制的最佳温度为900℃;②I.读表中信息可得,从反应开始到20min,NO的变化浓度=(1.00—0.40) mol∙L-1=0.60 mol∙L-1,根据平均反应速率的定义式可知,v(NO)=△c/△t=0.030mol•L-1•mol-1;由于固体物质浓度是常数,不需要写入平衡常数表达式,读表中信息可知,20min时该反应在T1℃时达到平衡,则K=[c(CO2)•c(N2)]/c2(NO2)=[0.30×0.30]/0.402≈0.56;II.30min改变条件后,根据三行数据法可知:
C (s) +2NO2(g)  N2 (g) + CO2
(g)
N2 (g) + CO2
(g)
起始浓度/mol•L-1 0.40 0.30 0.30
变化浓度/mol•L-1 0.080 0.040 0.040
平衡浓度/mol•L-1 0.32 0.34 0.34(2分)
由于二氧化碳的理论浓度比实际浓度大0.17mol/L,说明30min时从原平衡体系中移出了CO2,减小CO2的浓度;由于30min时生成物CO2的浓度减少了一半,则v逆(CO2)立即减少一半,所以起点的横坐标为30min、纵坐标为原平衡的一半;减小生成物浓度,平衡向正反应方向移动,则v逆(CO2)逐渐增大,直到40min才达到新的平衡,但是此时CO2的浓度比原平衡时小,因此v逆(CO2)比原平衡时小, 所以终点的横坐标为40min、纵坐标比原平衡的一半大,但是比原平衡时小。
考点:考查化学反应原理,涉及盖斯定律、温度对平衡移动的影响、放热反应和吸热反应、根据反应物配比及温度对转化率影响图像确定反应最佳温度、平均反应速率和平衡常数的计算、根据各组分的浓度时间变化表推断引起平衡移动的因素、画出逆反应速率-时间图像等。


科目:高中化学 来源: 题型:阅读理解
| 温度/℃ | 800 | 1000 | 1200 | 1400 |
| 平衡常数 | 0.45 | 1.92 | 276.5 | 1771.5 |
| n(NO) |
| n(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 浓度/mol?L-1 时间/min |
NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省苏中三市高三5月第二次调研测试化学试卷(解析版) 题型:填空题
(14分)乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:2CO(g)+4H2 (g)  CH3CH2OH(g)+H2O(g)
△H=—256.1kJ·mol—1。
CH3CH2OH(g)+H2O(g)
△H=—256.1kJ·mol—1。
已知:H2O(l)=H2O(g) △H=+44kJ·mol—1
CO(g)+H2O(g) CO2(g)+H2(g)
△H=—41.2kJ·mol—1
CO2(g)+H2(g)
△H=—41.2kJ·mol—1
⑴以CO2(g)与H2(g)为原料也可合成乙醇,其热化学方程式如下:
2CO2(g)+6H2(g)
 CH3CH2OH(g)+3H2O(l)
△H= 。
CH3CH2OH(g)+3H2O(l)
△H= 。
⑵CH4和H2O(g)在催化剂表面发生反应CH4+H2O CO+3H2,该反应在不同温度下的化学平衡常数如下表:
CO+3H2,该反应在不同温度下的化学平衡常数如下表:
|
温度/℃ |
800 |
1000 |
1200 |
1400 |
|
平衡常数 |
0.45 |
1.92 |
276.5 |
1771.5 |
①该反应是_____反应(填“吸热”或“放热”);
②T℃时,向1L密闭容器中投入1molCH4和1mol H2O(g),平衡时c(CH4)=0.5mol·L—1,该温度下反应CH4+H2O CO+3H2的平衡常数K= 。
CO+3H2的平衡常数K= 。
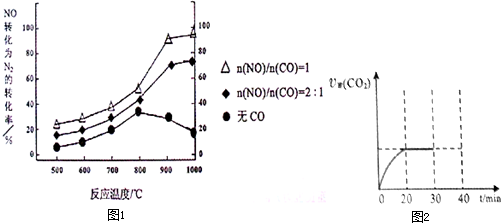
⑶汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究小组在实验室以Ag-ZSM-5 为催化剂,测得NO转化为N2的转化率随温度变化情况如图。
①若不使用CO,温度超过775℃,发现NO的分解率降低,其可能的原因为 ;在n(NO)/n(CO)=1的条件下,应控制的最佳温度在 左右。
②用CxHy(烃)催化还原NOx也可消除氮氧化物的污染。写出CH4与NO2发生反应的化学方程式: 。
⑷乙醇-空气燃料电池中使用的电解质是搀杂了Y2O3的ZrO2晶体,它在高温下能传导O2—离子。该电池负极的电极反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com