
| 实验序号 | ① | ② | ③ |
| 实验 内容 |  |  |  |
分析 (1)形成原电池后能加快金属的腐蚀速率;
(2)②构成原电池发生电化学腐蚀,铁作负极,碳作正极,电解质溶液为中性,发生吸氧腐蚀;
(3)金属的防护措施有牺牲阳极的阴极保护法、外加电流的阴极保护法,另外还有电镀、喷镀、喷油漆等方法使金属与空气、水等物质隔离,以防止金属腐蚀.
解答 解:(1)①蒸馏水中不含氧气,所以铁钉和蒸馏水不能构成原电池;
②铁钉和氯化钠溶液能构成原电池,铁作负极而被腐蚀;
③铁钉和醋酸能发生氧化还原反应而被腐蚀,所以铁钉腐蚀最慢的是①,
故答案为:①;
(2)②构成原电池发生电化学腐蚀,电解质溶液为中性,发生吸氧腐蚀,铁作负极,失电子发生氧化反应,电极反应为Fe-2e-=Fe2+,碳作正极,氧气得电子发生还原反应,电极反应为2H2O+O2+4e-=4OH-,溶液由中性变为碱性,故答案为:吸氧腐蚀;碱;2H2O+O2+4e-=4OH-;
(3)a.在自行车的钢圈表面镀镍,能阻止钢铁和电解质溶液构成原电池,所以能防腐,故正确;
b.铁、铜和电解质溶液构成原电池,铁比铜活泼,加快了铁的腐蚀,所以不能起到防腐作用,故错误;
c.在金属中加入一些其它物质制成合金,改变了金属的结构,所以能防腐,故正确;
故答案为:ac.
点评 本题考查了金属的腐蚀与防护,难度不大,根据金属腐蚀特点选取相应的保护方法.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:选择题
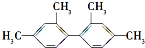 的烃,下列说法正确的是( )
的烃,下列说法正确的是( )| A. | 分子中至少有9个碳原子处于同一平面上 | |
| B. | 分子中至少有11个碳原子处于同一平面上 | |
| C. | 分子中至少有16个碳原子处于同一平面上 | |
| D. | 该烃的苯环上的一氯代物有5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2-甲基丁烷也称异丁烷 | |
| B. | 溴水与苯发生取代反应而褪色 | |
| C. | C4H9Cl有4种同分异构体 | |
| D. | 蔗糖和麦芽糖水解的最终产物都是葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相对原子质量和核电荷数 | B. | 电子层数和核内中子数 | ||
| C. | 电子层数和最外层电子数 | D. | 金属性和非金属性的强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH+H2O?H3O++CH3COO- | B. | CO32-+2H2O?H2CO3+2OH- | ||
| C. | HCO3-+H2O?H3O++CO32- | D. | HS-+H2O?H2S+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7 mol | B. | 6 mol | C. | 5 mol | D. | 4 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 原子半径:Y>X>W | B. | 氢化物的沸点:W>X>Y | ||
| C. | 氢化物的稳定性:R>Y>X | D. | 简单阴离子的还原性:Y>R>Z |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com