
分析 (1)Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质,可起到净水的作用;钢铁设备中的Fe会与铁离子反应生成亚铁离子;
(2)①根据电荷守恒:c(Cl-)=2c(Fe2+)+3c(Fe3+)+c(H+)(酸性溶液中OH-浓度很小,在这里可以忽略不计),据此溶液中氢离子的浓度,再根据pH=-lgc(H+)计算;
②氯酸钠氧化酸性的氯化亚铁,则反应物中有氢离子参加,则生成物中有水生成,Cl元素的化合价从+5价降低到-1价,得到6个电子,而Fe元素的化合价从+2价升高到+3价,失去1个电子,根据得失电子守恒,则氯酸根离子的系数为1,Fe2+的系数为6,则铁离子的系数也是6,氯离子的系数是1,根据电荷守恒,则氢离子的系数是6,水的系数是3;
(3)铁离子的水解分为三步,且水解程度逐渐减弱,所以水解平衡常数逐渐减小;控制条件使平衡正向移动,水解为吸热反应,所以降温平衡逆向移动;加水稀释,则水解平衡也正向移动;加入氯化铵,氯化铵溶液为酸性,氢离子浓度增大,平衡逆向移动;加入碳酸氢钠,则消耗氢离子,平衡正向移动;从反应的离子方程式中可知,氢离子的浓度影响高浓度聚合氯化铁的生成,所以关键步骤是调节溶液的pH.
解答 解:(1)Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质,可起到净水的作用;钢铁设备中的Fe会与铁离子反应生成亚铁离子,离子方程式是:2Fe3++Fe=3Fe2+,
故答案为:Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质;2Fe3++Fe=3Fe2+;
(2)①根据电荷守恒:c(Cl-)=2c(Fe2+)+3c(Fe3+)+c(H+)(酸性溶液中OH-浓度很小,在这里可以忽略不计),则c(H+)=c(Cl-)-2c(Fe2+)-3c(Fe3+)=1.0×10-2mol•L-1,则溶液pH=-lg1.0×10-2=2,
故答案为:2;
②氯酸钠氧化酸性的氯化亚铁,则反应物中有氢离子参加,则生成物中有水生成,Cl元素的化合价从+5价降低到-1价,得到6个电子,而Fe元素的化合价从+2价升高到+3价,失去1个电子,根据得失电子守恒,则氯酸根离子的系数为1,Fe2+的系数为6,则铁离子的系数也是6,氯离子的系数是1,根据电荷守恒,则氢离子的系数是6,水的系数是3,配平后离子方程式为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O,
故答案为:1;6;6H+;1;6;3H2O;
(3)铁离子的水解分为三步,且水解程度逐渐减弱,所以水解平衡常数逐渐减小,则K1>K2>K3,控制条件使平衡正向移动,使平衡正向移动,因为水解为吸热反应,所以降温,平衡逆向移动;加水稀释,则水解平衡也正向移动;加入氯化铵,氯化铵溶液为酸性,氢离子浓度增大,平衡逆向移动;加入碳酸氢钠,则消耗氢离子,所以氢离子浓度降低,平衡正向移动,故选bd;从反应的离子方程式中可知,氢离子的浓度影响高浓度聚合氯化铁的生成,所以关键步骤是调节溶液的pH,
故答案为:K1>K2>K3;bd;调节溶液的pH.
点评 本题考查铁的化合物性质的应用、氧化还原反应方程式的配平、对图象的分析能力、平衡移动影响因素等,需要学生具备扎实的基础与灵活运用难度,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
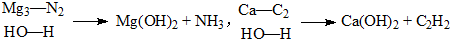
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | ① | ② | ③ |
| 实验 内容 |  |  |  |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
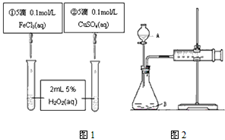 为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲乙两组同学分别设计了如图1、图2所示的实验.请回答下列问题
为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲乙两组同学分别设计了如图1、图2所示的实验.请回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;实验室制备气体A的化学方程式2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.
;实验室制备气体A的化学方程式2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.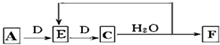
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

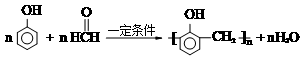 ,福尔马林是甲醛含量37%的水溶液,它的一个用途是浸制生物标本.
,福尔马林是甲醛含量37%的水溶液,它的一个用途是浸制生物标本.| 甲同学选择的试剂 | 乙同学认为不合理的理由 |
| 紫色石蕊试液 | |
| 新制氢氧化铜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com