
 .
. 分析 (1)根据烷烃的通式CnH2n+2计算;
(2)根据烯烃的通式CnH2n计算;
(3)环上的一氯代物只有两种,说明苯环上只有两种氢原子;
(4)式量最小的多元醇为甘油;
(5)TNT为三硝基甲苯.
解答 解:(1)烷烃的通式为CnH2n+2,则分子内含8个碳原子的烷烃应含有18个H,分子式为C8H18,故答案为:C8H18;
(2)烯烃的通式为CnH2n,则分子内含12个氢原子的烯烃含有6个C,分子式为C6H12,故答案为:C6H12;
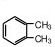
(3)苯环上的一溴取代物只有一种,说明苯环上只有一种氢原子,则2个碳原子不可能是形成1个乙基,乙苯苯环上有3种氢,此时有只能是2个甲基,且处于邻位位置,其结构简式为 ,
,
故答案为: ;
;
(4)式量最小的多元醇为甘油,结构简式为CH2OHCHOHCH2OH,故答案为:CH2OHCHOHCH2OH;
(5)TNT为三硝基甲苯,TNT的结构简式: ,故答案为:
,故答案为: .
.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析、计算能力的考查,注意把握有机物的结构以及分子的组成规律,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 除去N2中混有的O2:选用灼热的铜网 | |
| B. | 除去CO2中混有的CO:选用澄清石灰水 | |
| C. | 除去BaCO3固体中混有的BaSO4:选用稀硫酸 | |
| D. | 除去Fe粉中混有的Cu粉:选用稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同系物符合同一通式 | B. | 同分异构体具有相同的分子式 | ||
| C. | 同分异构体的化学性质基本相同 | D. | 同系物的化学性质基本相似 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7 mol | B. | 6 mol | C. | 5 mol | D. | 4 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LH2O含有的分子数为1 NA | |
| B. | 常温常压下,1.42g Na2SO4含有的Na+离子数为0.01 NA | |
| C. | 通常状况下,NA个CO2分子含有原子数为3 NA | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
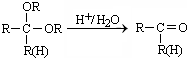
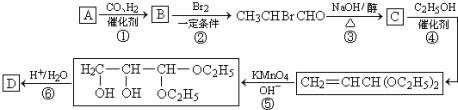
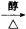 CH2=CHCHO+NaBr+H2O.
CH2=CHCHO+NaBr+H2O.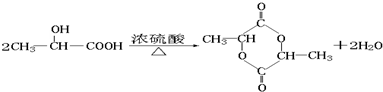 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com