

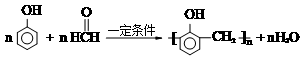 ,福尔马林是甲醛含量37%的水溶液,它的一个用途是浸制生物标本.
,福尔马林是甲醛含量37%的水溶液,它的一个用途是浸制生物标本.| 甲同学选择的试剂 | 乙同学认为不合理的理由 |
| 紫色石蕊试液 | |
| 新制氢氧化铜 |
分析 (1)苯酚与甲醛在一定条件下发生缩聚反应生成酚醛树脂,甲醛的水溶液有防腐的作用;
(2)碱石灰可吸收二氧化碳;甲醛易挥发;
(3)甲醛在光催化氧化条件下反应生成二氧化碳和水;
(4)白色沉淀为碳酸钡,甲醛的物质的量与碳酸钡的相等;
(5)排出装置中的二氧化碳;
(6)B中溶液呈碱性(NaOH足量),加紫色石蕊试液无法证明是甲酸;B中可能溶有过量的甲醛.
解答 解:(1)苯酚与甲醛在一定条件下发生缩聚反应生成酚醛树脂,反应方程式为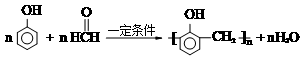 ,福尔马林中含有甲醛,能防腐,可用于浸制生物标本,
,福尔马林中含有甲醛,能防腐,可用于浸制生物标本,
故答案为: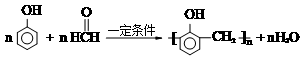 ;浸制生物标本;
;浸制生物标本;
(2)碱石灰可吸收空气中的二氧化碳,防止对产物检验测定造成干扰;恒温水浴可使甲醛挥发,
故答案为:吸收空气中的CO2(防止对产物检验测定造成干扰);使混合气中甲醛含量稳定(写使甲醛挥发亦可);
(3)甲醛在光催化氧化条件下反应生成二氧化碳和水,反应方程式HCHO+O2 $→_{紫外光}^{催化剂}$CO2+H2O,故答案为:HCHO+O2 $→_{紫外光}^{催化剂}$CO2+H2O;
(4)白色沉淀为碳酸钡,物质的量为$\frac{5.91g}{197g/mol}$=0.03mol,根据碳元素守恒,可知被氧化的甲醛的物质的量为0.03mol,故答案为:0.03;
(5)通入一会儿空气的目的排出装置中的二氧化碳,减小误差,故答案为:将残留在装置中的CO2排出,被NaOH吸收,减小误差;
(6)B中溶液呈碱性(NaOH足量),加紫色石蕊试液无法证明是甲酸;B中可能溶有过量的甲醛,无法证明是甲酸中醛基,故答案为:
| 甲同学选择的试剂 | 乙同学认为不合理的理由 |
| 紫色石蕊试液 | 紫色石蕊试液→B中溶液呈碱性(NaOH足量),无法证明是甲酸(酸性) |
| 新制氢氧化铜 | 新制氢氧化铜→B中可能溶有过量的甲醛,无法证明是甲酸中醛基 |
点评 本题考查探究物质的组成或测量物质的含量,难度中等,明确实验原理是解题的关键,注意有机物中官能团与性质的关系.


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LH2O含有的分子数为1 NA | |
| B. | 常温常压下,1.42g Na2SO4含有的Na+离子数为0.01 NA | |
| C. | 通常状况下,NA个CO2分子含有原子数为3 NA | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 原子半径:Y>X>W | B. | 氢化物的沸点:W>X>Y | ||
| C. | 氢化物的稳定性:R>Y>X | D. | 简单阴离子的还原性:Y>R>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 橙花醛能够发生氧化反应,不能发生还原反应 | |
| B. | 橙花醛可以使溴水褪色 | |
| C. | 橙花醛是丙烯醛是同系物 | |
| D. | 橙花醛与分子式为C10H20O的酮互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
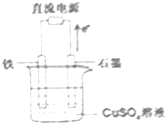 在如图所示装置中,石墨电极的电极反应式为4OH--4e-=2H2O+O2↑.如果开始加入的CuSO4足量,则电解一段时间,当电路中转移1.0mol电子时,要使溶液恢复至原浓度,可向其中加入的物质是CuO(填化学式),其质量为40g.
在如图所示装置中,石墨电极的电极反应式为4OH--4e-=2H2O+O2↑.如果开始加入的CuSO4足量,则电解一段时间,当电路中转移1.0mol电子时,要使溶液恢复至原浓度,可向其中加入的物质是CuO(填化学式),其质量为40g.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
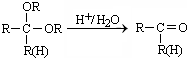
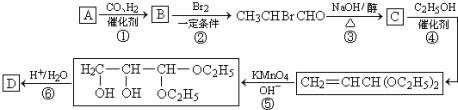
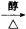 CH2=CHCHO+NaBr+H2O.
CH2=CHCHO+NaBr+H2O.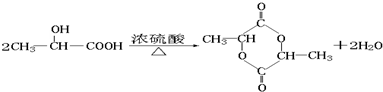 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NH4CNO和CO(NH2)2 | B. | CH2OHCHO和CH3COOH | ||
| C. | CH3OOCCH3和CH3COOCH3 | D. | 甘氨酸和CH3 CH2NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
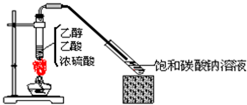 如图所示,实验室制乙酸乙酯1mL后,沿器壁加入紫色石蕊试液0.5mL,这时石蕊试液将存在于饱和碳酸钠溶液层与乙酸乙酯层之间(整个过程不振荡).对可能出现的现象,叙述正确的是
如图所示,实验室制乙酸乙酯1mL后,沿器壁加入紫色石蕊试液0.5mL,这时石蕊试液将存在于饱和碳酸钠溶液层与乙酸乙酯层之间(整个过程不振荡).对可能出现的现象,叙述正确的是| A. | 石蕊层仍为紫色,有机层无色 | |
| B. | 石蕊层有两层,上层为紫色,下层为蓝色 | |
| C. | 石蕊层为三层环,由上而下是红、紫、蓝 | |
| D. | 石蕊层为三层环,由上而下是蓝、紫、红 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com