
【题目】计算题
(1)常温常压下,已知Ksp(AgCl)=1.8×10-10,Ksp(Mg(OH)2)=5.6×10-12试通过计算说明饱和AgCl溶液和Mg(OH)2溶液溶解度的大小;并且说明溶度积与溶解度之间的关系;[已知1.8=1.34,1.41/3=1.12]
(2)常温下,将0.05mol/L盐酸溶液和未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的pH=12。用上述NaOH溶液13 mL和pH=3的某一元弱酸HA溶液20mL恰好完全反应生成NaA。试求:
①此一元弱酸的物质的量浓度。
②求此条件下该一元弱酸的电离平衡常数。
【答案】(1)同种类型:Ksp增大,S增大;Ksp减小,S减小;不同类型:不可用Ksp直接判断;(2)①0.26mol/L;②3.8×10-6
【解析】(1)已知Ksp(AgCl)=1.8×10-10,则饱和氯化银溶液中氯化银的浓度是![]() ,所以氯化银的溶解度是1.34×10-9×0.1×143.5g=1.9×10-6g;Ksp(Mg(OH)2)=5.6×10-12,则氢氧化镁溶液的浓度是
,所以氯化银的溶解度是1.34×10-9×0.1×143.5g=1.9×10-6g;Ksp(Mg(OH)2)=5.6×10-12,则氢氧化镁溶液的浓度是![]() ,所以氢氧化镁的溶解度是1.12×10-4×0.1×58g=6.5×10-4g;这说明同种类型:Ksp增大,S增大;Ksp减小,S减小;不同类型:不可用Ksp直接判断;
,所以氢氧化镁的溶解度是1.12×10-4×0.1×58g=6.5×10-4g;这说明同种类型:Ksp增大,S增大;Ksp减小,S减小;不同类型:不可用Ksp直接判断;
(2)①设氢氧化钠的浓度为xmol/L,盐酸和氢氧化钠混合溶液中c(OH-)=(2x0.05×1)/(1+2)
mol/L=1014/1012mol/L,(2x0.05)/(1+2)=0.01,x=0.04,氢氧化钠和HA以1:1反应,NaOH溶液13mL和pH=3的某一元弱酸HA溶液20.0mL恰好完全反应生成NaA,则氢氧化钠和HA的物质的量相等,设HA的浓度为ymol/L,0.04mol/L×0.013L=ymol/L×0.002L,解得y=0.26;②电离平衡常数K=c(H+)·c(A)/c(HA)=103×103/0.26103=3.8×10-6。


 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的数值,下列叙述正确的是( )
A. 10mL0.1mol/L的CH3COOH溶液中氧原子数为0.002NA
B. 0.2mol/L的NaCl溶液中,Na+数为0.2NA
C. 0.1mol的Na2O2与足量的CO2反应,转移电子数为0.1NA
D. 在标准状况下4.48L的CH2Cl2其分子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从含碘废液(除H2O外,还含有CCl4、I2、I-等)中回收碘和CCl4,其实验过程如下:

(1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为
______________;该操作将I2还原为I-的主要目的是 ____________ 。
(2)操作X的名称为 ___。
(3)氧化时,在三颈烧瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在40℃左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因是_____________;锥形瓶里盛放的溶液为_______________
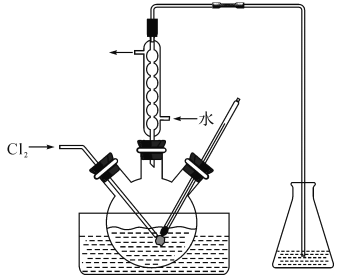
(4)在教材碘水的萃取实验中,最后要从碘的CCl4溶液中回收利用CCl4,可以采用下列方法:先水浴加热蒸馏碘的CCl4溶液,收集得到浅红色的液体。再向该液体中加入少量块状的活性炭,静置。待溶液的浅红色消失。操作Y,即可得无色透明的CCl4液体。
①收集得到浅红色的液体说明,收集得到的液体中含有 ___(化学式),②加入少量活性炭的目的是 ______ ,③操作Y的名称是 ___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素,a、b、c、d的原子序数依次增大。四种元素形成的单质依次为m、n、p、q时;x、y、z是这些元素组成的二元化合物,其中z为形成酸雨的主要物质之一;25℃,0.01mol·Lˉ1w溶液中,  。上述物质的转化关系如图所示。下列说法正确的是( )
。上述物质的转化关系如图所示。下列说法正确的是( )

A. 原子半径的大小:a<b<c<d B. 氢化物的沸点:b>d
C. x的电子式为:![]() D. y、w含有的化学键类型完全相同
D. y、w含有的化学键类型完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由Mg、P、S、Cl、Ni等元素组成的新型材料有着广泛的用途,请回答下列问题。
(1)基态Mg原子L层电子排布式为_____,P、S、Cl的第一电离能由大到小顺序为_______。
(2)PH4Cl的电子式为_________,Ni与CO能形成配合物Ni(CO)4,该分子中σ键与π键个数比为__________。
(3)SCl2分子中的中心原子杂化轨道类型是_______,该分子构型为_________。
(4)已知MgO与NiO的晶体结构(如图1)相同,其中Mg2+和Ni2+的离子半径分别为66pm和69 pm。则熔点:MgO_____NiO(填“>”、“<”或“=”),理由是_____________。

(5)如图1所示,NiO晶胞中离子坐标参数A为(0,0,0),B为(1,0,1),则C离子坐标参数为___________。
(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图2),已知O2-的半径为a m,每平方米面积上分散的该晶体的质量为______g。(用a、NA表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2002年诺贝尔化学奖获得者的贡献之一是发明了对有机分子的结构进行分析的质谱法。其方法是让极少量(10-9g左右)的化合物通过质谱仪的离子化室使样品分子大量离子化,少量分子碎裂成更小的离子。如C2H6离子化后可得到C2H6+、C2H5+、C2H4+、……然后测定其质荷比β。设H+的质荷比为1,某有机物样品的质荷比如下图(假设离子均带一个单位正电荷,信号强度与该离子多少有关),则该有机物可能

A. CH3OH B. C3H8 C. C2H4 D. CH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于有机物a(HCOOCH2CH2COOH)、b(HOOCCH2CH2CH2COOH)、c(HOOC-COOH),下列说法错误的是
A. a和b互为同分异构体
B. a 可发生水解反应和氧化反应
C. b 和c 均不能使酸性KMnO4溶液褪色
D. b的具有相同官能团的同分异构体还有3 种(不含立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质(或主要成分)对应的化学式中,不正确的是
A.小苏打 NaHCO3B.石碱 Na2CO3
C.绿矾 FeSO4·7H2OD.胃舒平 Al(OH)3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com