
【题目】2002年诺贝尔化学奖获得者的贡献之一是发明了对有机分子的结构进行分析的质谱法。其方法是让极少量(10-9g左右)的化合物通过质谱仪的离子化室使样品分子大量离子化,少量分子碎裂成更小的离子。如C2H6离子化后可得到C2H6+、C2H5+、C2H4+、……然后测定其质荷比β。设H+的质荷比为1,某有机物样品的质荷比如下图(假设离子均带一个单位正电荷,信号强度与该离子多少有关),则该有机物可能

A. CH3OH B. C3H8 C. C2H4 D. CH4
科目:高中化学 来源: 题型:
【题目】(1)等质量的CO和SO2分别装入同温同体积的容器,所含氧原子之比________,压强之比________。
(2)在标准状况下,由CO和CO2组成的混合气体8.96 L,质量是16g。此混合物中CO和CO2的物质的量之比是________,混合气体的平均摩尔质量是__________。
(3)将标准状况下224 L的HCl溶于1000g水配成密度为1.36g/cm3溶液,所得溶液的物质的量浓度为___________。
(4)在某温度时,一定量的元素A的气态氢化物AH3,在一定体积的密闭容器中完全分解成两种气体单质,此时压强增加了75%,则单质A的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列实验事实:
①Cr2O3固体既能溶于KOH溶液得到KCrO2溶液,又能溶于硫酸得到Cr2(SO4)3溶液;
②向KCrO2溶液中滴加H2O2溶液,再酸化,可得K2Cr2O7溶液;
③将K2Cr2O7溶液滴加到淀粉和KI的混合溶液中,溶液变蓝。
下列判断不正确的是( )
A.化合物KCrO2中Cr元素为+3价
B.实验①证明Cr2O3是两性氧化物
C.实验②证明H2O2既有氧化性又有还原性
D.实验③证明氧化性:Cr2O![]() >I2
>I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】计算题
(1)常温常压下,已知Ksp(AgCl)=1.8×10-10,Ksp(Mg(OH)2)=5.6×10-12试通过计算说明饱和AgCl溶液和Mg(OH)2溶液溶解度的大小;并且说明溶度积与溶解度之间的关系;[已知1.8=1.34,1.41/3=1.12]
(2)常温下,将0.05mol/L盐酸溶液和未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的pH=12。用上述NaOH溶液13 mL和pH=3的某一元弱酸HA溶液20mL恰好完全反应生成NaA。试求:
①此一元弱酸的物质的量浓度。
②求此条件下该一元弱酸的电离平衡常数。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列现象或操作不适宜用勒夏特列原理解释的是
A. 实验室可用CaO和浓氨水快速制取氨气
B. FeCl3溶液中加Fe粉,颜色由棕黄色变为浅绿色
C. 新制氯水放置一段时间颜色变浅
D. 锅炉水垢中含有CaSO4,常先加Na2CO3再加酸处理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用系统命名法对下列物质进行命名:
(1) _________________。
_________________。
(2) ____________________。
____________________。
(3) ________________。
________________。
(4) ____________________。
____________________。
(5)![]() _______________________。
_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米级Cu2O由于具有优良的催化性能而备受关往,下表为制取纳米级Cu2O的三种方法:
方法I | 用炭粉在高温条件下还原CuO |
方法Ⅱ | 电解法,反应为2Cu +H2O |
方法III | 用肼(N2H4)还原新制Cu(OH)2 |
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是反应条件不易控制,若控制不当易生成________________而使Cu2O产率降低
(2)已知:2Cu(s)+1/2O2(g)=Cu2O(s);△H = -akJ·mol-1
C(s)+1/2O2(g)=CO(g);△H = -bkJ·mol-1
Cu(s)+ 1/2O2(g)=CuO(s);△H = -ckJ·mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)= Cu2O(s)+CO(g);△H =_________kJ·mol-1
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如下图,阳极生成Cu2O,其电极反应式为___________________。

(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该反应的化学方程式为_________________________。
(5)肼又称联氨,易溶于水,是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因___________________。
(6)向1L恒容密闭容器中充入0.1molN2H4,在30℃、Ni-Pt催化剂作用下发生反应N2H4(g) ![]() N2(g)+2H2(g),测得混合物体系中,
N2(g)+2H2(g),测得混合物体系中, ![]() (用y表示)与时间的关系如图所示。0-4min时间内H2的平均生成速率v(H2)= ____ mol/(L·min);该温度下,反应的平衡常数=___________________。
(用y表示)与时间的关系如图所示。0-4min时间内H2的平均生成速率v(H2)= ____ mol/(L·min);该温度下,反应的平衡常数=___________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(ρ=1.84g/cm3)配制1mol/L稀硫酸100mL.
(1)实验操作:
a.用100mL量筒量取98%的浓硫酸___________mL;
b.选取对应规格的容量瓶,洗涤,检查是否漏液,将稀释并冷却至室温的硫酸溶液沿玻璃棒转移到此容量瓶中;
c.用少量蒸馏水洗涤小烧杯和玻璃棒2--3次,并将洗涤液转移到容量瓶中;
d.在小烧杯内稀释浓硫酸,稀释时要用玻璃棒不断搅拌;
e.向容量瓶中直接加蒸馏水至离刻度线1---2cm处;
f.盖上容量瓶瓶塞,摇匀;
g.用胶头滴管小心加蒸馏水至刻度线;
h.将配制好的溶液转移入含少量蒸馏水的试剂瓶中贮存备用.
(2)实验分析:
①正确的操作步骤是__________________________________________________(填序号).
②此实验中玻璃棒的作用是__________________________________________________.
③实验操作中有两处错误,这两处错误是:
I.____________________________________________________________Ⅱ._____________________________________________.
(3)下列操作对所配溶液的浓度有何影响?(填“偏高”“偏低”或“无影响”)
I.量取浓硫酸的量筒用蒸馏水洗涤两次,并将洗涤液转入容量瓶中______________.
II.定容时俯视容量瓶刻度线__________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常用作风信子等香精的定香剂D以及可用作安全玻璃夹层的高分子化合物PVB的合成路线如下:
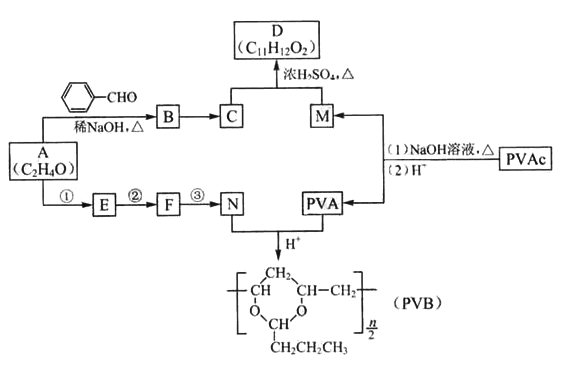
已知:I.RCHO+R’CH2CHO![]()
![]() +H2O(R、R’表示烃基或氢)
+H2O(R、R’表示烃基或氢)
II.醛与二元醇(如:乙二醇)可生成环状缩醛:

(1)A的核磁共振氢谱有两种峰。A的名称是_______________。
(2)A与![]() 合成B的化学方程式是_____________________。
合成B的化学方程式是_____________________。
(3)C为反式结构,由B还原得到。C的结构式是_______________。
(4)E能使Br2的CCl4溶液褪色。N由A经反应①~③合成。
a.①的反应试剂和条件是________________。
b.②的反应类型是_____________。
c.③的化学方程式是_________________________________________。
(5)PVAc由一种单体经加聚反应得到,该单体的结构简式是__________________。
(6)已知:
以溴乙烷和环氧乙烷为原料制备1﹣丁醇,设计合成路线(其他试剂任选).
合成路线流程图示例:![]()
__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com