
(15分)CO和H2的混合气体俗称合成气,是一种重要的工业原料气,工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气。
(1)已知:CH4、H2和CO的燃烧热(△H)分别为-890.3kJ/mol、-285.8kJ/mol和-283.0kJ/mol,且1mol液态水汽化时的能量变化为44.0kJ。用1 m3(标准状况)的甲烷与水蒸气在高温下反应制取合成气所需的热量为 (保留整数)。
(2)在一定温度下,向体积为2L的密闭容器中充入0.40mol CH4和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间变化如下表所示:
物质浓度 时间/min | 0 | 1 | 2 | 3 | 4 |
CH4 | 0.2mol·L-1 | 0.13 mol·L-1 | 0.1 mol·L-1 | 0.1 mol·L-1 | 0.09 mol·L-1 |
H2 | 0 mol·L-1 | 0.2 mol·L-1 | 0.3 mol·L-1 | 0.3 mol·L-1 | 0.33 mol·L-1 |
①计算该反应第一次达平衡时的平衡常数K 。
②3min时改变的反应条件是 (只填一种条件的改变即可)。
(3)已知温度、压强、投料比X[n(CH4)/n(H2O)]对该反应的影响如图所示。
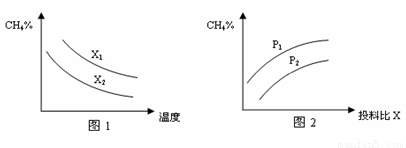
①图1中的两条曲线所示投料比的关系X1 X2(填“=”、“>”或“<”下同)。
②图2中两条曲线所示的压强比的关系:P1 P2。
(4)以天然气(设杂质不参与反应)、KOH溶液为原料可设计成燃料电池:
①放电时,负极的电极反应式为 。
②设装置中盛有100.0mL 3.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为8.96L,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为 。
科目:高中化学 来源:2014-2015学年江苏省扬州市高三上学期期末考试化学试卷(解析版) 题型:选择题
下列有关物质性质与应用对应关系错误的是
A.常温下,浓硫酸能使铝钝化,可用铝制容器贮运浓硫酸
B.二氧化硅熔点很高、硬度很大,可用于制造坩埚
C.氯化铁溶液能腐蚀铜,可用于制作印刷电路板
D.金属钠硬度小、密度小,可用于制造高压钠灯
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省西安市高三下学期二模考试理综化学试卷(解析版) 题型:填空题
[化学——选修3:物质结构与性质](15分)第ⅢA、ⅤA族元素组成的化合物AlN、AlP、AlAs等是人工合成的半导体材料,它们的晶体结构与单晶硅相似,与NaCl的晶体类型不同。
(1)核电荷数比As小4的原子基态的电子排布式为_________________________。
(2)前四周期元素中,基态原子中未成对电子与其所在周期数相同的元素有______种。
(3)NCl3中心原子杂化方式为________________,NCl3的空间构型为__________。
(4)在AlN晶体中,每个Al原子与________个N原子相连,AlN属于________晶体。
(5)设NaCl的摩尔质量为Mr g·mol-1,食盐晶体的密度为ρ g·cm-3,阿伏加德罗常数的值为NA。食盐晶体中两个距离最近的钠离子中心间的距离为________cm。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南周口市高三3月教学质量监测理综化学试卷(解析版) 题型:实验题
(15分)2Na2CO3·3H2O2是一种新型的氧系漂白剂。某实验兴趣小组进行了如下实验。
Ⅰ.实验制备
实验原理:2Na2CO3+3H2O2=2Na2CO3·3H2O2
实验步骤:取3.5 g Na2CO3溶于10 mL H2O,加入0.1 g稳定剂,用磁力搅拌器搅拌完全溶解后,将6.0 mL 30%H2O2在15 min内缓慢加入到三颈烧瓶中,实验装置如图。
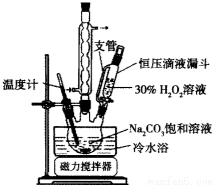
反应1小时后,加入1g氯化钠后,静置结晶,然后抽滤,干燥一周后,称重。
(1)装置中球形冷凝管的作用是______________。
(2)使用冷水浴的作用是______________________________________________。
(3)加入适量NaCl固体的原因是_______________________________________。
(4)2Na2CO3·3H2O2极易分解,其反应方程式可表示为_________________________________。
Ⅱ.活性氧含量测定
准确称取试样0.2000 g,置于250 mL锥形瓶中,加100 mL浓度为6%的硫酸溶液,用0.0200 mol/L高锰酸钾标准溶液滴定,记录高锰酸钾标准溶液消耗的体积为
32.70 mL。
活性氧含量计算公式:Q%=(40cV/m)×100%[c KMnO4标准溶液浓度(mol/L);V
KMnO4标准溶液浓度(mol/L);V 消耗的KMnO4标准溶液体积(L);m
消耗的KMnO4标准溶液体积(L);m 试样质量(g)]
试样质量(g)]
(5)滴定终点的判断依据为______________________________________________。
(6)滴定过程中涉及的化学方程式_______________________________________。
(7)活性氧含量为__________________________。
Ⅲ.产品纯度的测定
(8)为了测定产品中2Na2CO3·3H2O2的质量分数,设计了几种方案,涉及不同的反应原理。
方案一 将试样与MnO2混合均匀,向混合物中滴加水,测生成气体的体积,进而进行计算。
方案二 _________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南周口市高三3月教学质量监测理综化学试卷(解析版) 题型:选择题
化学与生产、生活密切相关,下列叙述中正确的是
A.用活性炭为糖浆脱色和用双氧水漂白纸浆,其原理相同
B.铜制品在潮湿空气中生锈,其主要原因是发生析氢腐蚀
C.用NaHCO3和Al2(SO4)3溶液可以制作泡沫灭火剂
D.从海水中可以制取NaCl,电解饱和NaCl溶液可以制取金属Na
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省新校高三4月模拟化学试卷(解析版) 题型:选择题
短周期中的A、B、C、D、E五种元素,原子序数依次增大,A和D,C和E分别同主族,A为非金属元素,且A与B的原子序数之和等于C的原子序数,C2-与D+的核外电子数相等。则下列说法正确的是
A.B与A只能组成BA3化合物
B.C、D、E形成的化合物与稀硫酸可能发生氧化还原反应
C.A、B、C形成的化合物一定不能发生水解反应
D.E的氧化物对应的水化物一定有强的氧化性
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省淮北市高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
(15分)H、C、N、O、Al、Fe是六种常见元素。
(1)Fe位于周期表第 周期,第 族,其基态原子未成对电子数为_______。碳的同素异形体中,金刚石熔点比C60 _____(填“高”、“低”)。
(2)用“>”或“<”填空:
离子半径 | 电负性 | 第一电离能 | 沸点 |
O2-____Al3+ | C___N | N____O | CH4____ NH3 |
(3)Al能将污水中NO3-转化为N2,同时铝的反应产物还能净化污水,该反应的离子方程式 ;其中产生的铝的化合物能净水的原理是 。
(4)已知①2H2(g) + O2(g) = 2H2O(l) △H=﹣571.66kJmol-1
②CH2=CH2(g) + 3O2(g) = 2CO2(g) + 2H2O(l) △H=﹣1306.42kJmol-1
写出利用CO2和H2合成(CH2=CH2)的热化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省黄山市高三毕业班第二次质量检测理综化学试卷(解析版) 题型:选择题
常温F,下列各组粒子在指定溶液中一定能大量共存的是
A.FeCl3溶液中:K+、C6H5OH、Br-、NO3一
B.在氨水溶液中Al3+、NO3一、Cl-、 Ag+
C.某透明澄清的溶液中:NH4+、 Fe3+、NO3一、C1-
D.能使甲基橙显红色的溶液:K、Cr2O72-、CH3CH2OH、SO42一
查看答案和解析>>
科目:高中化学 来源:2014-2015四川省邛崃市高一下学期第一次月考化学试卷(解析版) 题型:选择题
铅蓄电池的两极分别为Pb、PbO2,电解质溶液为H2SO4,电池放电时时的反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O,下列对电池放电时的分析正确的
A.Pb为正极被氧化 B.电子从PbO2 流向外电路
C.SO42-向PbO2处移动 D.电解质溶液pH不断增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com