
| A. | 氯原子的电子排布式3s23p5 | B. | Cl-的结构示意图  | ||
| C. | 氯离子的电子式Cl- | D. | 质量数为37的氯原子${\;}_{37}^{17}$Cl |
分析 A.Cl所含质子数为17,原子核外电子数为17,根据能量最低原则、泡利不相容原理和洪特规则排布;
B.氯离子核内17个质子,核外18个电子,分布在3个电子层,从内到外依次排布2,8,8个电子;
C.氯离子为阴离子,电子式中需要标出最外层所带电荷;
D.原子组成的表示式中元素符号的下角表示质子数,左上角表示质量数.
解答 解:A.Cl所含质子数为17,原子核外电子数为17,根据能量最低原则、泡利不相容原理和洪特规则核外电子排布式为1s22s22p63s23p5,故A错误;
B.氯离子核内17个质子,核外18个电子,分布在3个电子层,从内到外依次排布2,8,8个电子,结构示意图 ,故B正确;
,故B正确;
C.氯离子为阴离子,电子式中需要标出其最外层电子,氯离子正确的电子式为: ,故C错误;
,故C错误;
D.元素符号的左下角的数字表示质子数,右上角的数字表示质量数,质量数为37的氯原子的表达式为3717Cl,故D错误;
故选:B.
点评 本题考查了常见化学用语的表示方法判断,题目难度中等,注意掌握离子结构示意图、电子式、元素符号等化学用语的概念及书写原则,试题培养了学生灵活应用基础知识的能力和规范答题能力.


科目:高中化学 来源: 题型:选择题
| A. | 2aPa | B. | 2$\sqrt{a}$Pa | C. | $\frac{2}{3}$aPa | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
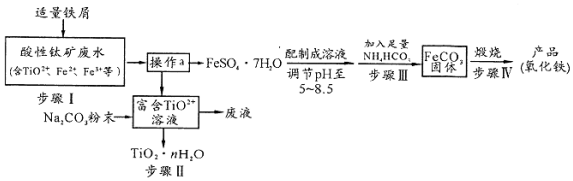
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烯烃的含碳量一定高于烷烃 | |
| B. | 烷烃分子中只含有碳碳单键,烯烃分子中只含有碳碳双键 | |
| C. | 烷烃不能发生加成反应,烯烃不能发生取代反应 | |
| D. | 相同条件下,烷烃的沸点一点高于烯烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将lmol H2和1molCl2光照或点燃后的产物 | |
| B. | 6.02×1023个HCl气体分子 | |
| C. | 室温下,将1molHCl气体通入100mL水中所得溶液 | |
| D. | 室温下,73gHCl气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C-C | C-H | Si-Si | Si-H |
| 键能/(kJ•mol-1) | 356 | 413 | 226 | 318 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO42- | B. | HCO3- | C. | SO32- | D. | Br- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com