
����Ŀ���±���Ԫ�����ڱ���һ���֣�����������ĸ�ֱ����һ��Ԫ�أ�NAΪ�����ӵ�������ֵ����

��1��Ԫ��Bλ��Ԫ�����ڱ��� ������s������p������d��������
��2����A��X��K����Ԫ���е�ij�����γɵĻ������У�ÿ��ԭ�Ӷ����������Ϊ8�����ȶ��ṹ�������� �������ʽ����
��3��ֻ��A��E��������Ԫ�صľ�����г����ԣ������ͳ��������һ��������ͼ��ʾ���þ���Ļ�ѧʽΪ ��

��4��Ԫ��D��K�γɵĻ������У�ÿ����������Χ�����������ȵ��������� �������û����ᄃ����ܶ�Ϊa g/cm3����������� cm3��
���𰸡���1��p����
��2��CCl4��PCl3��
��3��MgCNi3��
��4��12��![]() ��
��
���������������������Ԫ�����ڱ�֪��AΪ̼Ԫ�أ�BΪ��Ԫ�أ�DΪ��Ԫ�أ�E��þԪ�أ�FΪ��Ԫ�أ�XΪ��Ԫ�أ�KΪ��Ԫ�أ�MΪ��Ԫ�أ�
��1�����ݻ�̬ԭ�Ӻ�������Ų�ʽ����������������ȷ���������ƣ�
��2�������������������γɵĹ��ۼ����ж�8�����ȶ��ṹ��
��3�����þ�̯��ȷ�������Ļ�ѧʽ��
��4�������Ȼ��Ƶľ���ͼ�����������ܶȺ���������V=![]() ��
��
�⣺AΪ̼Ԫ�أ�BΪ��Ԫ�أ�DΪ��Ԫ�أ�E��þԪ�أ�FΪ��Ԫ�أ�XΪ��Ԫ�أ�KΪ��Ԫ�أ�MΪ��Ԫ�أ�
��1����ԭ�ӵĵ����Ų�ʽ��1s22s22p6��������p���ӣ�������ԭ��λ��p����
�ʴ�Ϊ��p����
��2����C��P��Cl�е�ij�����γɵĻ������У�ÿ��ԭ�Ӷ����������Ϊ8�����ȶ��ṹ��������CCl4��PCl3��
�ʴ�Ϊ��CCl4��PCl3��
��3��̼ԭ��λ�ڸþ����������ϣ����Ըþ����к���һ��̼ԭ�ӣ�þԭ�Ӹ���=8��![]() =1�����Ըþ�������1��þԭ�ӣ���ԭ�Ӹ���=6��
=1�����Ըþ�������1��þԭ�ӣ���ԭ�Ӹ���=6��![]() =3���þ����к���3����ԭ�ӣ����Ըþ����Ļ�ѧʽΪMgCNi3��
=3���þ����к���3����ԭ�ӣ����Ըþ����Ļ�ѧʽΪMgCNi3��
�ʴ�Ϊ��MgCNi3��
��4����֪�Ȼ��Ƶľ���ͼΪ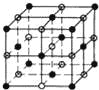 ��������ÿ��Na+��Χ�����������ȵ�Na+����12����
��������ÿ��Na+��Χ�����������ȵ�Na+����12����
�þ����������Ӹ���=1+12��![]() =4�������Ӹ���=8��
=4�������Ӹ���=8��![]() +6��
+6��![]() =4������1���Ȼ��ƾ����к���4���Ȼ��ƣ����������V=
=4������1���Ȼ��ƾ����к���4���Ȼ��ƣ����������V=![]() =
=![]() cm3��
cm3��
�ʴ�Ϊ��12��![]() ��
��


 ��������ѧ����ϵ�д�
��������ѧ����ϵ�д� ��Ԫ������ĩ��ϵ�д�
��Ԫ������ĩ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ŵ�����Ⱦ���������أ�����������ʮ�������ڼ䣬����������(SO2)�ŷ������� 8%����������(NOx)�ŷ������� 10%��Ŀǰ������������Ⱦ�ж��ַ�����
��1���� CH4 ����ԭ��������������������������Ⱦ��
��֪����CH4(g) + 4NO2(g) = 4NO(g) + CO2(g) + 2H2O(g)��H =��574 kJ/mol
��CH4(g) + 4NO(g) = 2N2(g) + CO2(g) + 2H2O(g)��H =��1160 kJ/mol
��H2O(g) = H2O(l) ��H =��44.0 kJ/mol
д�� CH4(g)�� NO2(g)��Ӧ���� N2(g)��CO2(g)�� H2O(l)���Ȼ�ѧ����ʽ��__________��
��2������ Fe2+��Fe3+�Ĵ������������¿ɽ� SO2 ת��Ϊ SO42-���Ӷ�ʵ�ֶ� SO2 ����������֪�� SO2 �ķ���ͨ�뺬 Fe2+��Fe3+����Һʱ������һ����Ӧ�����ӷ���ʽΪ 4Fe2+ + O2 + 4H+ = 4Fe3+ + 2H2O������һ��Ӧ�� ���ӷ���ʽΪ__________��
��3���û���̿��ԭ��������������йط�ӦΪ C(s) + 2NO(g) ![]() N2(g) + CO2(g)��ij�о�С�����ܱյ���� ������(��������������䣬��������������Բ���)���� NO �������Ļ���̿���ں���(T1��)�����·�Ӧ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
N2(g) + CO2(g)��ij�о�С�����ܱյ���� ������(��������������䣬��������������Բ���)���� NO �������Ļ���̿���ں���(T1��)�����·�Ӧ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
Ũ��(mol/L) | NO | N2 | CO2 |
0 | 1.00 | 0 | 0 |
10 | 0.58 | 0.21 | 0.21 |
20 | 0.40 | 0.30 | 0.30 |
30 | 0.40 | 0.30 | 0.30 |
40 | 0.32 | 0.34 | 0.17 |
50 | 0.32 | 0.34 | 0.17 |
��10��20 min ����(N2)��ʾ�ķ�Ӧ����Ϊ__________��
���÷�Ӧ��ƽ�ⳣ������ʽ K=________�����ݱ������ݣ����� T1 ��ʱ�÷�Ӧ��ƽ�ⳣ��Ϊ__________(������λС��)��
��һ���¶��£����� NO ����ʼŨ�������� NO ��ƽ��ת����__________ (
�����и�������Ϊ�жϸ÷�Ӧ�ﵽƽ�����__________ (�����)��
A�����������ܶȱ��ֲ���
B������(NO) = 2����(CO2)
C��������ѹǿ���ֲ���
D�������� N2 ������������ֲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ijԪ�ص�ԭ�������������Ƴ���Ԫ��ԭ�ӵģ���
A. ������ B. ������ C. ������ D. �˵����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A. �ơ����Ż�ʱ����������ĭ��������
B. ��������ұ����������ԭ�ϣ�Ҳ�ǽϺõ��ͻ����
C. ʯӢ��������ά��ԭ�ϣ�Ҳ�dz��õİ뵼�����
D. ������β��ϵͳ�а�װ��ת�������ɽ���β����CO��NOx�ȵ��ŷ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ǿ������ɫ��Һ�У������������ܴ����������
A. Na+��K+ ��OH-��Cl- B. Na+��Cu2+��SO42-��NO3-
C. K+��Mg2+��SO42-��Cl- D. Ba2+��HCO3-��NO3-��K+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���У���ȷ���ǣ� ��
A��44 g CO2�������22.4 L
B��NH3��Ħ��������17g/mol
C��100 mL 1 mol/L NaCl��Һ�к���1 mol Cl��
D����״���£�11.2 L H2O�к���3.01��1023��ˮ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.1mol MnO2��ĩ���뵽50mL����������Һ��H2O2����=1.1g/mL���У��ڱ�״���·ų�����������ʱ��Ĺ�ϵ��ͼ��ʾ��
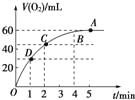
��1��ʵ��ʱ�ų������������� ��
��2���ų�һ�����������ʱ��Ϊ ��
��3����Ӧ�ų�![]() ������������ʱ��ԼΪ ��
������������ʱ��ԼΪ ��
��4��A��B��C��D���㷴Ӧ���ʵĿ���˳��Ϊ
��5�����ͷ�Ӧ���ʱ仯��ԭ��
��6������H2O2��ʼ״̬��Ũ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��1 mol������к���2 mol Si��Si������ҵ�Ͽ�ͨ�����з�Ӧ��ȡ�ߴ��裺SiCl4(g)��2H2(g)![]() Si(s)��4HCl(g)�������±��оٵĻ�ѧ���ļ������ݣ��жϸ÷�Ӧ�ķ�Ӧ��(��H)Ϊ(����)
Si(s)��4HCl(g)�������±��оٵĻ�ѧ���ļ������ݣ��жϸ÷�Ӧ�ķ�Ӧ��(��H)Ϊ(����)
��ѧ�� | Si��O | Si��Cl | H��H | H��Cl | Si��Si | Si��C |
����/kJ��mol��1 | 460 | 360 | 436 | 431 | 176 | 347 |
A����412 kJ��mol��1 B����412 kJ��mol��1
C����236 kJ��mol��1 D����236 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ʵıȽ��У�����ȷ����
A. ���ԣ�NaOH��Mg(OH)2
B. ���ȶ��ԣ�HCl��HBr
C. ʧ����������K��Na
D. ԭ�Ӱ뾶��Cl��S
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com