
【题目】已知:1 mol晶体硅中含有2 mol Si—Si键。工业上可通过下列反应制取高纯硅:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g),根据下表列举的化学键的键能数据,判断该反应的反应热(ΔH)为( )
Si(s)+4HCl(g),根据下表列举的化学键的键能数据,判断该反应的反应热(ΔH)为( )
化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
A.+412 kJ·mol-1 B.-412 kJ·mol-1
C.+236 kJ·mol-1 D.-236 kJ·mol-1
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列物质,所含分子数最多的是(NA为阿伏加德罗常数)
A. 10gH2 B. 2molCl2 C. 1.5NACO2 D. 22.4LO2(标况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列字母分别代表一种元素(NA为阿伏加德罗常数的值).

(1)元素B位于元素周期表的 (填“s”、“p”或“d”)区.
(2)由A、X、K三种元素中的某两种形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质有 (填分子式).
(3)只含A、E和镍三种元素的晶体具有超导性.该新型超导晶体的一个晶胞如图所示,该晶体的化学式为 .

(4)元素D和K形成的化合物中,每个阳离子周围距离最近且相等的阳离子有 个,若该化合物晶体的密度为a g/cm3,则晶胞的体积是 cm3.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置合理且能达到实验目的的是

A. 实验室用装置①制取氨气
B. 装置②将化学能转化为电能
C. 装置③可用于分离沸点相差较大的互溶液体混合物
D. 装置④可用于Fe(OH)2的制取,并能防止Fe(OH)2被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列热化学方程式:
①C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ/mol
②H2(g)+![]() O2(g)===H2O(l) ΔH2=-285.8 kJ/mol
O2(g)===H2O(l) ΔH2=-285.8 kJ/mol
③CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH3=-870.3 kJ/mol
可以计算出2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热为( )
A.ΔH=+244.1 kJ/mol B.ΔH=-488.3 kJ/mol
C.ΔH=-996.6 kJ/mol D.ΔH=+996.6 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(8分) 研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)对于反应:2SO2(g)+O2(g)![]() 2SO3(g);如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)= ;υ(SO3)= 。
2SO3(g);如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)= ;υ(SO3)= 。
(2)已知:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g) ![]() 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g) ![]() SO3(g)+NO(g)的ΔH=______ kJ·mol-1。
SO3(g)+NO(g)的ΔH=______ kJ·mol-1。
(3)一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是______。
a、体系压强保持不变 b、混合气体颜色保持不变
c、SO3和NO的体积比保持不变 d、每消耗1 mol SO3的同时生成1 mol NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C是由周期表中短周期元素组成的三种常见化合物,甲、乙、丙是三种单质,这些单质和化合物之间存在如图1所示的关系,完成下列空白:
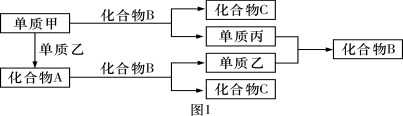
(1)向酚酞试液中加入化合物A的粉末,现象为 。
(2) 单质甲与化合物B反应的离子方程式为 。5.05 g单质甲—钾合金溶于200 mL水生成0.075 mol氢气,确定该合金的化学式为__ __。
(3)向20 mL某浓度的化合物C的溶液中通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同。若向M中逐滴加入0.1 mol/L盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图2图示两种情况。
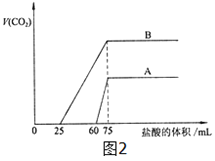
①由A确定滴加前60 mL的盐酸时,发生反应的离子方程式为 。
②由B表明,原溶液通入CO2气体后,所得溶液中的溶质的化学式为__ __。
③由A、B可知,两次实验通入的CO2的体积比为__ __。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种常见的强氧化剂。实验室以精选铬铁矿(主要成分可表示为FeO.Cr2O3,还含有SiO2、Al2O3等杂质)为原料制备重铬酸钾晶体(K2Cr2O7,式量294)的流程如下:

请回答下列问题:
(1)操作1中发生的反应有:
4FeO·Cr2O3 + 8Na2CO3 + 7O2 = 8Na2CrO4 + 2Fe2O3 + 8CO2↑
Na2CO3 + Al2O3 = 2NaAlO2 + CO2↑ Na2CO3 + SiO2 = Na2SiO3 + CO2↑
该步骤在常温下的反应速率较慢,为使反应速率增大,可采取的措施是_____________________,__________________________。(写出两条)
(2)固体Y中主要含有 ______________。(填写化学式)
(3)酸化步骤使含铬物质发生了转化为_________,请写出离子反应方程式____________。
(4)操作4中的化学反应在溶液中能发生的可能理由是_________________,获得晶体的操作依次是:加入KCl固体,在水浴上加热浓缩至____________________,冷却结晶,抽滤、洗涤、干燥。
(5)通过下列实验可测定产品中重铬酸钾的质量分数:
称取重铬酸钾试样1.470g,用100mL容量瓶配制成溶液。移取25.00mL溶液于碘量瓶中,加入适量稀硫酸和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min。然后加入一定量的水,加入淀粉指示剂,用0.1500mol/L Na2S2O3标准溶液滴定,共消耗标准液36.00mL。滴定时发生的反应的离子方程式为:I2 + 2S2O32- = 2I- + S4O62-则所测定产品中重铬酸钾的纯度为___________。
(6)有关上述实验过程中涉及的部分实验操作的描述,正确的是____________。
A.粗产品若要进一步提纯,可以采用重结晶的方法
B.配制溶液时,用托盘天平称取试样后,一般经溶解、转移(含洗涤)、定容等步骤,配制成100mL溶液
C.滴定时,当最后一滴标准溶液滴入时,溶液变为蓝色,且半分钟内不变色,可判断滴定终点
D.滴定终点时俯视读数,测定结果偏低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com