
【题目】(8分) 研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)对于反应:2SO2(g)+O2(g)![]() 2SO3(g);如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)= ;υ(SO3)= 。
2SO3(g);如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)= ;υ(SO3)= 。
(2)已知:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g) ![]() 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g) ![]() SO3(g)+NO(g)的ΔH=______ kJ·mol-1。
SO3(g)+NO(g)的ΔH=______ kJ·mol-1。
(3)一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是______。
a、体系压强保持不变 b、混合气体颜色保持不变
c、SO3和NO的体积比保持不变 d、每消耗1 mol SO3的同时生成1 mol NO
【答案】⑴ 0.025 mol·L-1·min-1;0.05 mol·L-1·min-1 ⑵-41.8 ⑶b、d (每空2分共8分)
【解析】
试题分析:(1)反应速率之比是相应的化学计量数之比,所以根据方程式可知如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)=0.025 mol·L-1·min-1,υ(SO3)=0.05 mol·L-1·min-1。
(2)已知:① 2SO2(g)+O2(g)![]() 2SO3(g) ΔH1=-196.6 kJ·mol-1
2SO3(g) ΔH1=-196.6 kJ·mol-1
② 2NO(g)+O2(g)![]() 2NO2(g) ΔH2=-113.0 kJ·mol-1
2NO2(g) ΔH2=-113.0 kJ·mol-1
(①-②)/2即得出2NO2(g)+2SO2(g)![]() 2SO3(g)+2NO(g) ΔH=(ΔH1-ΔH2)/2=(-196.6 kJ·mol-1 +113.0 kJ·mol-1)/2=-41.8kJ·mol-1。
2SO3(g)+2NO(g) ΔH=(ΔH1-ΔH2)/2=(-196.6 kJ·mol-1 +113.0 kJ·mol-1)/2=-41.8kJ·mol-1。
(3)a、反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)的特点体积不变的、吸热的可逆反应,因此压强始终不变,a错误;b、颜色的深浅与气体的浓度大小有关,而在反应体系中只有二氧化氮是红棕色气体,所以混合气体颜色保持不变时即说明NO2的浓度不再发生变化,b正确;c、SO3和NO是生成物,因此在任何情况下二者的体积比总是满足1:1,c错误;d、SO3和NO均作为生成物,因此每消耗1 mol SO3的同时生成1 mol NO表面正逆反应速率相等,反应达到平衡状态,d正确,答案选bd。
SO3(g)+NO(g)的特点体积不变的、吸热的可逆反应,因此压强始终不变,a错误;b、颜色的深浅与气体的浓度大小有关,而在反应体系中只有二氧化氮是红棕色气体,所以混合气体颜色保持不变时即说明NO2的浓度不再发生变化,b正确;c、SO3和NO是生成物,因此在任何情况下二者的体积比总是满足1:1,c错误;d、SO3和NO均作为生成物,因此每消耗1 mol SO3的同时生成1 mol NO表面正逆反应速率相等,反应达到平衡状态,d正确,答案选bd。


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】将0.1mol MnO2粉末加入到50mL过氧化氢溶液(H2O2,ρ=1.1g/mL)中,在标准状况下放出气体的体积和时间的关系如图所示.
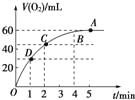
(1)实验时放出气体的总体积是 .
(2)放出一半气体所需的时间为 .
(3)反应放出![]() 体积气体所需的时间约为 .
体积气体所需的时间约为 .
(4)A,B,C,D各点反应速率的快慢顺序为
(5)解释反应速率变化的原因:
(6)计算H2O2初始状态的浓度 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:1 mol晶体硅中含有2 mol Si—Si键。工业上可通过下列反应制取高纯硅:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g),根据下表列举的化学键的键能数据,判断该反应的反应热(ΔH)为( )
Si(s)+4HCl(g),根据下表列举的化学键的键能数据,判断该反应的反应热(ΔH)为( )
化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
A.+412 kJ·mol-1 B.-412 kJ·mol-1
C.+236 kJ·mol-1 D.-236 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X的原子有3个电子层,最外层有4个电子。这种元素位于周期表的
A. 第4周期ⅢA族 B. 第4周期ⅦA族
C. 第3周期ⅣB族 D. 第3周期ⅣA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将BaO2放入密闭的真空容器中,反应2BaO2(s)![]() 2BaO(s)+O2(g)达到平衡。保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是( )
2BaO(s)+O2(g)达到平衡。保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是( )
A. 平衡常数减小 B. BaO量不变 C. 氧气压强不变 D. BaO2量增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组性质的比较中,不正确的是
A. 碱性:NaOH>Mg(OH)2
B. 热稳定性:HCl>HBr
C. 失电子能力:K>Na
D. 原子半径:Cl>S
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com