
【题目】下列物质中,能使酸性高锰酸钾溶液褪色的是( )
A. 甲烷 B. 乙烯 C. 苯 D. 乙酸
 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】在生产、保存、运输和使用浓硫酸时,下列说法不正确的是
A.工业制取硫酸过程中生成的SO2可循环使用
B.常温下可选用铁制或铝制容器盛装
C.盛装容器的标签上应标注氧化剂和腐蚀品
D.使用时向其中直接加水可制得稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一反应物的浓度是2.0molL﹣1,经过2min后,它的浓度变成了1.56molL﹣1,则在这2min内它的平均反应速率为( )
A.0.22 mol(Lmin)﹣1 B.0.1 mol(Lmin)﹣1
C.0.04 mol(Lmin)﹣1 D.0.08 mol(Lmin)﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质性质与用途的对应关系不正确的是( )
选项 | 性质 | 用途 |
A | 氧化铁呈红棕色 | 红色涂料 |
B | 氧化铝熔点很高 | 耐火材料 |
C | 浓硫酸具有脱水性 | 干燥剂 |
D | 液氨汽化时要吸收大量的热 | 制冷剂 |
A.A B.B C.C D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(8分) 研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)对于反应:2SO2(g)+O2(g)![]() 2SO3(g);如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)= ;υ(SO3)= 。
2SO3(g);如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)= ;υ(SO3)= 。
(2)已知:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g) ![]() 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g) ![]() SO3(g)+NO(g)的ΔH=______ kJ·mol-1。
SO3(g)+NO(g)的ΔH=______ kJ·mol-1。
(3)一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是______。
a、体系压强保持不变 b、混合气体颜色保持不变
c、SO3和NO的体积比保持不变 d、每消耗1 mol SO3的同时生成1 mol NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是

选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A. | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B. | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
C. | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
D. | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种分子的球棍模型如下图所示(图中球与球之间的连线可代表单键、双键、叁键等):

不同形式的球代表不同的原子,对该物质的判断正确的是
A. ①处的化学键是碳碳双键
B. ②处的原子可能是氯原子
C. 该分子中的原子不可能均在同一直线上
D. 该分子不存在链状同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、硫和氮元素及其化合物的处理,是资源利用和环境保护的重要研究课题。
⑴CO可转化成二甲醚,原理为:2CO(g) + 4H2(g) ![]() CH3OCH3(g) + H2O(g),已知一定条件下,该反应中CO的平衡转化率随温度、投料比的变化曲线如下图左所示,若温度升高,则反应的平衡常数K将 (填“增大”、“减小”或“不变”)
CH3OCH3(g) + H2O(g),已知一定条件下,该反应中CO的平衡转化率随温度、投料比的变化曲线如下图左所示,若温度升高,则反应的平衡常数K将 (填“增大”、“减小”或“不变”)

⑵SO2的水溶液呈酸性,某温度下,0.02mol/L亚硫酸水溶液的pH等于2,若忽略亚硫酸的二级电离和H2O的电离,则该温度下亚硫酸的一级电离平衡常数Ka1= 。
⑶已知:反应1 2SO2(g) + O2(g) ![]() 2SO3(g) ΔH1
2SO3(g) ΔH1
反应2 2NO(g) + O2(g) ![]() 2NO2(g) ΔH2
2NO2(g) ΔH2
若ΔH1 <ΔH2 < 0,则反应3 SO2(g) + NO2(g) ![]() SO3(g) + NO(g) 属于 (填“放热”或“吸热”)反应。
SO3(g) + NO(g) 属于 (填“放热”或“吸热”)反应。
⑷若用少量NaOH溶液吸收SO2气体,对产物NaHSO3进一步电解可制得硫酸,电解原理示意图(见上图右所示),则电解时阳极的电极反应式为 。
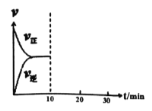
⑸在恒温密闭容器中通入SO2和NO2各1mol发生反应3:SO2(g) + NO2(g) ![]() SO3(g) + NO(g),当反应达到平衡后(此时NO2的转化率为α1),维持温度和容积不变,10min时再通入各1mol的SO2和NO2的混合气体,20min时再次平衡(此时NO2的转化率为α2)。两次平衡时NO2的转化率α1 α2(填“>”、“<”、“=”),并在下图中画出正反应速率在10-30min间随时间变化的曲线图。
SO3(g) + NO(g),当反应达到平衡后(此时NO2的转化率为α1),维持温度和容积不变,10min时再通入各1mol的SO2和NO2的混合气体,20min时再次平衡(此时NO2的转化率为α2)。两次平衡时NO2的转化率α1 α2(填“>”、“<”、“=”),并在下图中画出正反应速率在10-30min间随时间变化的曲线图。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com