
【题目】同分异构体和同系物是两个不同的概念,观察下面列出的几种物质的分子式或结构简式,回答下列问题。
①CO(NH2)2 ②NH4CNO ③CH3CH2CH3 ④CH3CH2CH2CH3 ⑤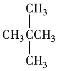 ⑥
⑥![]() ⑦
⑦![]() ⑧
⑧![]()
(1)互为同分异构体的是_________;
(2)互为同系物的是___________;
(3)实际上是同种物质的是____。
【答案】①和②,④与⑦,⑤与⑥(或者⑧) ⑥⑧ ③、④、⑤、⑥(或者⑧)、⑦
【解析】
(1)化学式为分子式相同、结构不同的有机化合物,则为同分异构体;
(2)结构相似、分子组成相差若干个“CH2”原子团的有机化合物互相称为同系物;
(3)分子式及结构均相同的为同种物质,以此解答该题。
(1)①和②,④与⑦,⑤与⑥(或者⑧)分子式相同,但结构不同,属于同分异构体;
故答案为:①和②,④与⑦,⑤与⑥(或者⑧);
(2)③、④、⑤、⑥(或者⑧)、⑦都属于烷烃,结构相似、分子组成相差若干个“CH2”原子团的有机化合物,属于同系物,故答案为:③、④、⑤、⑥(或者⑧)、⑦;
(3)⑥与⑧分子式相同,结构相同,为同种物质;
故答案为:⑥⑧。


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】我国的四大发明之一黑火药,爆炸时发生反应的化学方程式为:S + 2KNO3 + 3C → K2S + 3CO2↑+ N2↑。请根据其中所含的元素回答下列问题:
(1)如图所示为元素周期表中钾元素框图,数据“39.10”表示的是________;钾元素在周期表中的位置为___________________。
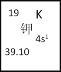
(2)上述元素中,简单离子电子层结构与氩原子相同,且离子半径最大的元素,其原子核外有_____种不同能级的电子;已知其氧化物中一种对应水化物能与氯单质反应,该反应的化学方程式是__________________________________。
(3)上述反应生成物中,属于非电解质的是_________________(写结构式);其中熔点最高的物质的电子式是______________。
(4)上述化学方程式的元素中,属于同周期元素的非金属性由强到弱的顺序为_______________,能证明其递变规律的事实是_______________(填字母)。
A、最高价氧化物对应水化物的酸性 B、气态氢化物的沸点
C、单质与氢气反应的难易程度 D、其两两组合形成的化合物中元素的化合价
(5)上述反应中,如1.5mol还原剂________(填“得到”或“失去”)________ mol电子,则生成_________ g还原产物。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不能用勒夏特列原理解释的事实是( )
A. 氯水中有下列平衡:Cl2+H2O![]() HCl+HClO,光照后氯水颜色变浅
HCl+HClO,光照后氯水颜色变浅
B. 合成氨工业使用高压以提高氨的产量
C. 对于H2(g)+I2(g)![]() 2HI(g),达平衡后,缩小容器体积可使体系颜色变深
2HI(g),达平衡后,缩小容器体积可使体系颜色变深
D. 汽水型饮料打开瓶盖后产生大量气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为:3Zn +2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+ 4KOH,下列叙述不正确的是( )
3Zn(OH)2+2Fe(OH)3+ 4KOH,下列叙述不正确的是( )
A.放电时负极反应为:Zn – 2e-+ 2OH- = Zn(OH)2
B.充电时阴极反应为:Fe(OH)3- 3e-+ 5OH- = FeO42-+ 4H2O
C.放电时每转移3mol电子,正极有1mol K2FeO4被还原
D.放电时正极附近溶液的碱性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.一密封体系中发生下列反应:N2+3H2![]() 2NH3 ΔH<0,下图是某一时间段中反应速率与反应进程的曲线关系图:
2NH3 ΔH<0,下图是某一时间段中反应速率与反应进程的曲线关系图:
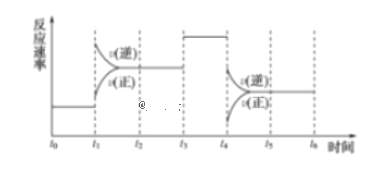
回答下列问题:
(1)处于平衡状态的时间段是___________、___________、___________。
(2)t1、t3、t4时刻体系中分别是什么条件发生了变化:____________、___________、___________。
(3)下列各时间段时,氨的百分含量最高的是___________(填序号)。
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
II.830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g)![]() CO2(g)+H2(g)△H<0。试回答下列问题:
CO2(g)+H2(g)△H<0。试回答下列问题:
(4)若起始时c(CO)=2mol·L-1,c(H2O)=3mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=____________。
(5)在相同温度下,若起始时c(CO)=1mol·L-1,c(H2O)=2mol·L-1,反应进行一段时间后,测得H2的浓度为0.5mol·L-1,则此时该反应是否达到平衡状态______(填“是”与“否”),此时v(正)____v(逆)(填“大于”“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是合成某药物的中间体分子(由9个碳原子和若干氢、氧原子构成)的结构示意图:
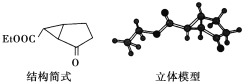
试回答下列问题:
(1)通过对比上面的结构简式与立体模型,请指出结构简式中的“Et”表示的基团是(写结构简式)_____;该药物中间体的分子式为________。
(2)该分子中含有_________个不饱和碳原子。
(3)该药物中间体中含氧官能团的名称为___________。
(4)该药物中间体分子中与碳原子结合的氢原子被溴原子取代,所得的一溴代物有______种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 环己酮是一种重要的有机化工原料。实验室合成环己酮的反应如下:
环己酮是一种重要的有机化工原料。实验室合成环己酮的反应如下:

环己醇和环己酮的部分物理性质见下表:
物质 | 相对分子质量 | 沸点(℃) | 密度(g·cm-3,20℃) | 溶解性 |
环己醇 | 100 | 161.1 | 0.9624 | 能溶于水和醚 |
环己酮 | 98 | 155.6 | 0.9478 | 微溶于水,能溶于醚 |
现以20 mL环己醇与足量Na2Cr2O7和硫酸的混合液充分反应,制得主要含环己酮和水的粗产品,然后进行分离提纯。分离提纯过程中涉及的主要步骤(未排序):
a.蒸馏,除去乙醚后,收集151~156℃馏分;
b.水层用乙醚(乙醚沸点34.6 ℃,易燃烧)萃取,萃取液并入有机层;
c.过滤;
d.往液体中加入NaCl固体至饱和,静置,分液;
e.加入无水MgSO4固体,除去有机物中少量水。
回答下列问题:
(1)上述分离提纯步骤的正确顺序是__________ (填字母)。
(2)b中水层用乙醚萃取的目的是_______。
(3)以下关于萃取分液操作的叙述中,不正确的是__________。
A.水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞,如图用力振荡
B.振荡几次后需打开分液漏斗上口的玻璃塞放气
C.经几次振荡并放气后,手持分液漏斗静置待液体分层
D.分液时,需先将上口玻璃塞打开或玻璃塞上的凹槽对准漏斗口上的小孔,再打开旋塞待下层液体全部流尽时,再从上口倒出上层液体
(4)在上述操作d中,加入NaCl固体的作用是__________。蒸馏除乙醚的操作中采用的加热方式为________。
(5)蒸馏操作时,一段时间后发现未通冷凝水,应采取的正确方法是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将 1.0 L w mol·L-1 CH3COOH 溶液与 0.1 mol NaOH固体混合,充分反应。然后向混合液中加入CH3COOH或CH3COONa固体(忽略体积和温度变化),溶液pH的变化如图。下列叙述正确的是
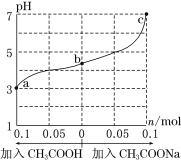
A.b点混合液中c(Na+)>c(CH3COO-)
B.加入CH3COOH过程中,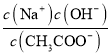 增大
增大
C.c点存在:c(CH3COOH)+c(CH3COO-) =0.1+w
D.a、b、c对应的混合液中,水的电离程度由大到小的顺序是c>a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度.则下列说法正确的是( )
A.物质的量:甲<乙B.气体体积:甲>乙
C.摩尔体积:甲>乙D.相对分子质量:甲>乙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com