
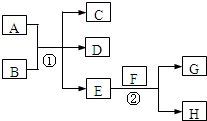
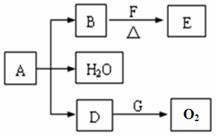
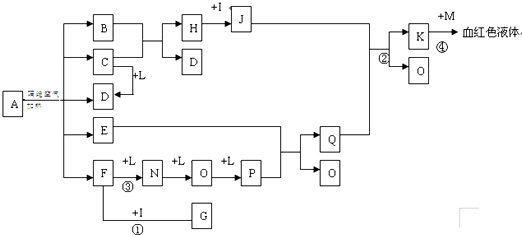
 已知常温下E为无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已略),请回答下列问题:
已知常温下E为无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已略),请回答下列问题: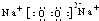
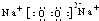
| ||
| ||
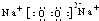 ,
,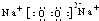 ;0.2NA或1.024×1023;
;0.2NA或1.024×1023;
| ||
| ||


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 CH3CHO+H2O+Cu
CH3CHO+H2O+Cu CH3CHO+H2O+Cu
CH3CHO+H2O+Cu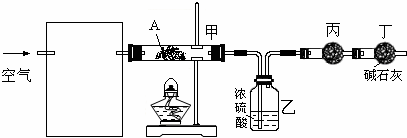
查看答案和解析>>
科目:高中化学 来源: 题型:
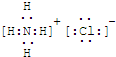
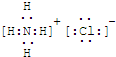
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖北省荆州市高三毕业班质量检查(二)理综化学试卷(解析版) 题型:填空题
如图表示各物质之间的转化关系。已知D、E、Z是中学化学常见的单质,其他都是化合物。Z、Y是氯碱工业的产品。D元素的原子最外层电子数与电子层数相等,且D的硫酸盐可作净水剂。E为日常生活中应用最广泛的金属。除反应①外,其他反应均在水溶液中进行。请回答下列问题。

(1)写出X的电子式:??????????? 。
(2)常温时pH =12的G溶液中,溶质的阳离子与溶质的阴离子浓度之差为?????????? (写出计算式)。
(3)在电镀工业中,若将E作为待镀金属,铜为镀层金属,则铜是____极,请写出在E电极上发生的电极反应式:????????????? 。
(4)写出反应③的离子方程式:??????????????????? 。
(5)现有无标签的Y和M的两种无色水溶液,不用其他任何试剂,请你设计一个简单的实验对这两种溶液加以鉴别???????????????? (回答实验操作、现象及结论)。
(6)A溶液与NaOH溶液混合可形成沉淀,某温度下此沉淀的Ksp =2.097×l0-39。将0.01 mol/L的A溶液与0.001 mol·L-1的NaOH溶液等体积混合,你认为能否形成沉淀____(填“能”或“不能”),请通过计算说明????????????????????????????? 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年浙江省宁波市十校高三3月联考理综化学试卷(解析版) 题型:填空题
2013年10月我市因台风菲特遭受到重大损失,市疾控中心紧急采购消毒药品,以满足灾后需要。复方过氧化氢消毒剂具有高效、环保、无刺激无残留,其主要成分H2O2是一种无色粘稠液体,请回答下列问题:
(1)下列方程中H2O2所体现的性质与其可以作为消毒剂完全一致的是??????? 。
A.BaO2+2HCl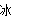 H2O2+BaCl2
H2O2+BaCl2
B.Ag2O+H2O2 =2Ag+O2+H2O???
C.2H2O2 2H2O+O2↑
2H2O+O2↑
D.H2O2+NaCrO2+NaOH=Na2CrO4 +H2O
(2)火箭发射常以液态肼(N2H4)为燃料,液态H2O2为助燃剂。已知:
N2H4(1)+O2(g)=N2(g)+2H2O(g)? △H= - 534 kJ·mol-1???
H2O2(1)=H2O(1)+1/2O2(g)? △H= - 98.64 kJ·mol-1
H2O(1)=H2O(g)? △H=+44kJ·mol-l
则反应N2H4(1)+2H2O2(1)=N2(g)+4H2O(g)的△H=?????????? ,
该反应的△S=??????? 0(填“>”或“<”)。
(3)H2O2是一种不稳定易分解的物质。
①如图是H2O2在没有催化剂时反应进程与能量变化图,请在图上画出使用催化剂加快分解速率时能量与进程图

②实验证实,往Na2CO3溶液中加入H2O2也会有气泡产生。已知常温时H2CO3的电离常数分别为Kal=4.3×l0-7,Ka2 = 5.0 ×l0-11 。Na2CO3溶液中CO32-第一步水解常数表达式Khl=????? ,常温时Khl的值为??????????? 。若在Na2CO3溶液中同时加入少量Na2CO3固体与适当升高溶液温度,则Khl的值
?????????? (填变大、变小、不变或不确定)。
(4)某文献报导了不同金属离子及其浓度对双氧水氧化降解海藻酸钠溶液反应速率的影响,实验结果如图1、图2所示。

注:以上实验均在温度为20℃、w(H2O2)=0.25%、pH=7.12、海藻酸钠溶液浓度为8mg·L-l的条件下进行。图1中曲线a:H2O2;b:H2O2+Cu2+;c:H2O2+Fe2+;d:H2O2+Zn2+;e:H2O2+Mn2+;图2中曲线f:反应时间为1h;g:反应时间为2h;两图中的纵坐标代表海藻酸钠溶液的粘度(海藻酸钠浓度与溶液粘度正相关)。
由上述信息可知,下列叙述错误的是????????????????? (填序号)。
A.锰离子能使该降解反应速率减缓
B.亚铁离子对该降解反应的催化效率比铜离子低??????
C.海藻酸钠溶液粘度的变化快慢可反映出其降解反应速率的快慢?????
D.一定条件下,铜离子浓度一定时,反应时间越长,海藻酸钠溶液浓度越小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com