
【题目】对下列物质分类全部正确的是
①纯碱 ②食盐水 ③石灰水 ④氢氧化钠 ⑤液态氧 ⑥氯酸钾
A. 碱——①④ B. 纯净物——③④⑤
C. 盐——①⑥ D. 混合物——②⑤
 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
【题目】下列预测某些碱金属元素及其化合物的性质的结论错误的是( )
选项 | 已知某些碱金属元素及其单质的性质 | 预测某些碱金属元素及其单质的性质 |
A | 锂、钠、钾三种元素在自然界中都以化合态存在 | 铷元素和铯元素在自然界中都以化合态存在 |
B | 钾单质与空气中的氧气反应比钠单质更剧烈,甚至能燃烧 | 铷单质和铯单质比钾单质更容易与氧气反应,遇到空气就会立即燃烧 |
C | 钾单质与水反应比钠单质更剧烈,甚至爆炸 | 铷和铯比钾更容易与水反应,遇水立即燃烧,甚至爆炸 |
D | 锂元素和钠元素在化合物中的化合价都是 | 锂单质与氧气反应生成的氧化物有 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.096 kg碳完全燃烧生成CO2气体可放出3147.9 kJ的热量,则下列热化学方程式正确的是( )
A. C(s)+O2(g)===CO2(g) ΔH=-393.49 kJ/mol
B. C(s)+O2(g)===CO2(g) ΔH=+393.49 kJ/mol
C. C+O2===CO2 ΔH=-393.49 kJ/mol
D. C(s)+![]() O2(g)===CO(g) ΔH=-393.49 kJ/mol
O2(g)===CO(g) ΔH=-393.49 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I 用Cl2生产某些含氯有机物时会产生副产物HCl,利用反应A可实现氯的循环利用。反应A:4HCl+O2![]() 2Cl2+2H2O。
2Cl2+2H2O。
已知:ⅰ反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
ⅱ.

(1)H2O的电子式是______________________。
(2)反应A的热化学方程式是_________________________________________________。
(3)断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为________ kJ,H2O中H—O键比HCl中H—Cl键________(填“强”或“弱”)。
II 在一定条件下,可逆反应A2(g) + B2(g) ![]() 2C(g)达到平衡时,各物质的平衡浓度c(A2)=0.5 mol·L-1、c(B2)=0.1 mol·L-1、c(C)=1.6 mol·L-1,若用a、b、c分别表示A2、B2、C的初始浓度(mol·L-1),则:
2C(g)达到平衡时,各物质的平衡浓度c(A2)=0.5 mol·L-1、c(B2)=0.1 mol·L-1、c(C)=1.6 mol·L-1,若用a、b、c分别表示A2、B2、C的初始浓度(mol·L-1),则:
(1)a、b应满足的关系是________________________________;
(2)a的取值范围是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组用下图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭![]() 中。
中。
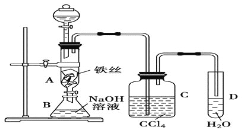
(1)写出A中反应的化学方程式:___________。
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是___________,有关反应的化学方程式是___________。
(3)C中盛放CCl4的作用是___________。
(4)要证明苯和液溴发生的是取代反应,而不是加成反应实验方法是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施能明显增大原反应的化学反应速率的是( )
A.Na与水反应时增大水的用量
B.将稀H2SO4改为98%的浓H2SO4与Zn反应制取H2
C.恒温、恒容条件下,在工业合成氨反应中,增加氢气的量
D.在H2SO4与NaOH两溶液反应时,增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2 mol SO2和2 mol SO3气体混合于固定体积的密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g) ![]() 2SO3(g),平衡时,SO3为n mol,相同温度下,分别按下列配比在相同容积的密闭容器中放入起始物质,平衡时,SO3的物质的量大于n mol的是( )
2SO3(g),平衡时,SO3为n mol,相同温度下,分别按下列配比在相同容积的密闭容器中放入起始物质,平衡时,SO3的物质的量大于n mol的是( )
A. 2 mol SO2和1 mol O2B. 4 mol SO2和1 mol O2
C. 2 mol SO2、1 mol O2和2 mol SO3D. 2 mol SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)现有反应:CO(g)+ H2O(g)![]() CO2(g)+ H2(g) ;△H<0。在850℃时,平衡常数K=1。
CO2(g)+ H2(g) ;△H<0。在850℃时,平衡常数K=1。
(1)若升高温度到950℃时,达到平衡时K__ ___1(填“>”、“<”或“=”)
(2)850℃时,若向一容积可变的密闭容器中同时充入 1.0 mol CO、3.0molH2O、1.0mol CO2和 x molH2,则:
①当x=5.0时,上述平衡向_______(填“正反应”或“逆反应”)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是________。
(3)在850℃时,若设x=5.0 mol和x=6.0mol,其它物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a _______ b(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组利用下图装置制取乙酸乙酯,其中A盛浓硫酸,B盛乙醇、无水醋酸,D盛饱和碳酸钠溶液。
已知:
①氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH;
②几种有机物沸点:乙醚34.7℃,乙醇78.5℃,乙酸117.9℃,乙酸乙酯77.1℃;
③乙酸与乙醇反应生成酯的过程中酸分子断裂C-O键,醇分子断裂O—H键。

请回答:
(1)乙醇分子中官能团的名称是__________________。
(2)A的名称是_____________;浓硫酸的主要作用是作____________________。
(3)在B中加入几块碎瓷片的目的是_______;C除起冷凝作用外,另一重要作用是_____。
(4)若参加反应的乙醇为CH3CH2l8OH,请写出用该乙醇制乙酸乙酯的化学方程式__________;该反应类型为___________。
(5)D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,其净化过程如下:
ⅰ:加入无水氯化钙,去除_________________;
ⅱ:最好加入________(填字母序号)作吸水剂;
A 碱石灰 B 氢氧化钾 C 无水硫酸钠
ⅲ:蒸馏,收集77℃左右的馏分,得到较纯净的乙酸乙酯。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com