
【题目】用如图所示装置进行实验:
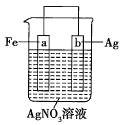
若图中x轴表示流入正极的电子的物质的量,则y轴可以表示:①![]() ,②
,②![]() ,③a棒的质量,④b棒的质量,⑤溶液的质量中的( )
,③a棒的质量,④b棒的质量,⑤溶液的质量中的( )
A.①③B.②④C.①③⑤D.②④⑤
科目:高中化学 来源: 题型:
【题目】实验室可利用环己醇的氧化反应制备环己酮,反应原理和实验装置(部分夹持装置略)如下:

有关物质的物理性质见下表。
物质 | 沸点(℃) | 密度(g·cm-3,20℃) | 溶解性 |
环己醇 | 161.1(97.8)* | 0.96 | 能溶于水和醚 |
环己酮 | 155.6(95.0)* | 0.95 | 微溶于水,能溶于醚 |
水 | 100.0 | 1.0 |
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点。
实验中通过装置B将酸性Na2Cr2O7溶液加到盛有10 mL环己醇的A中,在55 ~ 60℃进行反应。反应完成后,加入适量水,蒸馏,收集95 ~ 100℃的馏分,得到主要含环己酮粗品和水的混合物。
(1)装置D的名称为____________________________。
(2)酸性Na2Cr2O7溶液氧化环己醇反应的![]() ,反应剧烈将导致体系温度迅速上升,副反应增多。
,反应剧烈将导致体系温度迅速上升,副反应增多。
①滴加酸性Na2Cr2O7溶液的操作为____________________________________________;
②蒸馏不能分离环己酮和水的原因是__________________________________________。
(3)环己酮的提纯需要经过以下一系列的操作:
a.蒸馏、除去乙醚后,收集151~156℃馏分
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.过滤
d.往液体中加入NaCl固体至饱和,静置,分液
e.加人无水MgSO4固体,除去有机物中少量的水
①上述提纯步骤的正确顺序是________________________________________________;
②B中水层用乙醚萃取的目的是______________________________________________;
③上述操作c、d中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需要的玻璃仪器有__________,操作d中,加入NaC1固体的作用是_____________________________。
(4)恢复至室温时,分离得到纯产品体积为6 mL,则环已酮的产率为____________。(计算结果精确到0.1%)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为一定条件下有关反应A(g)+B(g)![]() xC(g) ΔH<0的图像。其中图甲表示起始A(g)、B(g)的物质的量一定,不同温度时,A的平衡转化率随容器压强的变化。图乙表示温度、容器体积和起始A(g)的物质的量一定,改变起始充入B(g)的物质的量,所得反应物的平衡转化率随充入B(g)的物质的量的变化。下列依据图像所得结论正确的是
xC(g) ΔH<0的图像。其中图甲表示起始A(g)、B(g)的物质的量一定,不同温度时,A的平衡转化率随容器压强的变化。图乙表示温度、容器体积和起始A(g)的物质的量一定,改变起始充入B(g)的物质的量,所得反应物的平衡转化率随充入B(g)的物质的量的变化。下列依据图像所得结论正确的是
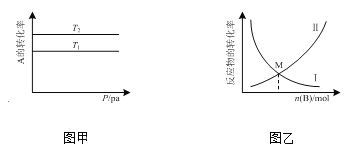
A.T1>T2
B.x=1
C.图乙中曲线Ⅰ表示的反应物是A(g)
D.M点时起始A(g)、B(g)的物质的量之比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.氯乙烯、聚乙烯均可使酸性高锰钾溶液褪色
B.煤的干馏、石油的分馏、油脂硬化均属于物理变化
C.![]() 与
与![]() 互为同分异构体,
互为同分异构体,![]() 谱显示两者均有三种不同的氢原子且三种氢原子的比例相同,故不能用
谱显示两者均有三种不同的氢原子且三种氢原子的比例相同,故不能用![]() 来鉴别
来鉴别
D.按系统命名法,化合物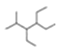 的名称为
的名称为![]() 甲基
甲基![]() ,
,![]() 二乙基己烷
二乙基己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向20.00mL 0.1000mol·L1盐酸中滴加0.1000mol·L1 NaOH溶液,溶液的pH随NaOH溶液体积的变化如图,已知lg3=0.5,邻苯二甲酸为弱酸。下列说法不正确的是( )
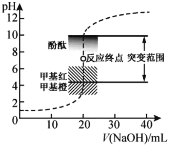
A.选择变色范围在pH突变范围内的指示剂,可减小实验误差
B.用酸式滴定管量取20.00mL 0.1000mol·L1盐酸时,酸式滴定管水洗后需用待取液润洗
C.NaOH标准溶液浓度的准确性直接影响分析结果的可靠性,因此需用邻苯二甲酸氢钠标定NaOH溶液的浓度,标定时采用甲基橙为指示剂
D.V(NaOH)=10.00mL 时,pH约为1.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组用如下图所示装置制备高铁酸钾(K2FeO4)。已知K2FeO4微溶于KOH溶液,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
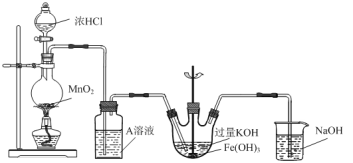
(1)A溶液的作用是__________,从平衡的角度解释用A溶液而不是水的原因:_______。
(2)写出制取K2FeO4的化学方程式:_______。
(3)实验小组测定所得样品中K2FeO4含量的方法如下:
步骤1:准确称取1.0g K2FeO4样品于锥形瓶中,加入KOH溶液和过量的NaCrO2溶液充分反应;
步骤2:向步骤1所得溶液中加入足量稀硫酸;
步骤3:向步骤2所得溶液中滴加指示剂,用浓度为0.4000 mol·L-1 (NH4)2Fe(SO4)2标准溶液滴定,反应至终点时消耗(NH4)2Fe(SO4)2标准溶液体积为30.00 mL。已知测定过程中发生反应的离子方程式为:FeO![]() +CrO
+CrO![]() +2H2O=Fe(OH)3↓+CrO
+2H2O=Fe(OH)3↓+CrO![]() +OH-;2H++2CrO
+OH-;2H++2CrO![]() =Cr2O
=Cr2O![]() +H2O;H++Fe2++Cr2O
+H2O;H++Fe2++Cr2O![]() —Fe3++Cr3++H2O(未配平);
—Fe3++Cr3++H2O(未配平);
计算样品中K2FeO4的质量分数,写出计算过程_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ实验室里需要纯净的氯化钠溶液,但实验室只有混有硫酸钠、碳酸氢铵的氯化钠.某学生设计了如下方案进行提纯:
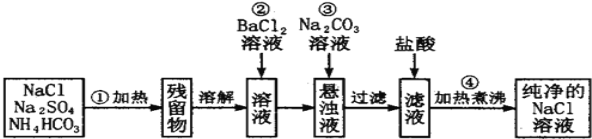
(1)操作②能否改为加硝酸钡溶液,______(填“能”或“否”) ,理由_____________________________。
(2)进行操作②后,如何判断SO42- 已除尽,方法是___________________。
(3)操作④的目的是_______________________________。
Ⅱ硫酸亚铁铵(NH4)2SO4·FeSO4·6H2O为浅绿色晶体,实验室中常以废铁屑为原料来制备,其步骤如下:
步骤1 将废铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。
步骤2 向处理过的铁屑中加入过量的3mol/L H2SO4溶液,在60℃左右使其反应到不再产生气体,趁热过滤,得FeSO4溶液。
步骤3 向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到硫酸亚铁铵晶体。
请回答下列问题:
(1)在步骤1中,分离操作,所用到的玻璃仪器有___________________________。(填仪器编号)
①漏斗 ②分液漏斗 ③烧杯 ④广口瓶 ⑤铁架台 ⑥玻璃棒 ⑦酒精灯
(2)在步骤3中,“一系列操作”依次为_____________________、_______________________和过滤。
(3)实验室欲用18mol/L H2SO4来配制240mL 3mol/L H2SO4溶液,需要量取________mL浓硫酸,实验时,下列操作会造成所配溶液浓度偏低的是__________________。(填字母)
a.容量瓶内壁附有水珠而未干燥处理 b.未冷却至室温直接转移至容量瓶中
c.加水时超过刻度线后又倒出 d.定容时仰视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】E是某药物中间体,其合成路线如图:

已知:![]() ;
;
![]() 、Y、C在核磁共振氢谱上都只有一个峰。
、Y、C在核磁共振氢谱上都只有一个峰。
请回答下列问题:
(1)![]() 、
、![]() 的反应类型分别为______、______。
的反应类型分别为______、______。
(2)![]() 生成Z的化学方程式为______。
生成Z的化学方程式为______。
(3)![]() 中所含的官能团名称是______。
中所含的官能团名称是______。
(4)![]() 的化学方程式为______。
的化学方程式为______。
(5)![]() 是A的同系物,在F的同分异构体中,属于烯烃与水的加成产物的有______种
是A的同系物,在F的同分异构体中,属于烯烃与水的加成产物的有______种![]() 不考虑立体结构
不考虑立体结构![]() ,其中核磁共振氢谱有四个峰,且峰面积之比为1:2:3:6的是______
,其中核磁共振氢谱有四个峰,且峰面积之比为1:2:3:6的是______![]() 填结构简式
填结构简式![]() 。
。
(6)设计以B为原料制备草酸![]()
![]() 的合成路线:______。
的合成路线:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质一定属于同系物的是( )
①![]() ;②
;②![]() ;③
;③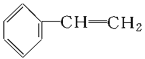 ;④C2H4;⑤CH2=CH-CH=CH2;⑥C3H6;⑦
;④C2H4;⑤CH2=CH-CH=CH2;⑥C3H6;⑦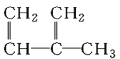 ;⑧
;⑧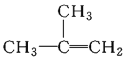
A.④和⑧B.①②和③C.⑦和⑧D.④⑥和⑧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com