
分析 (1)工业上将氯气通入到石灰乳中在制取漂白粉,氯气与碱反应生成金属氯化物和次氯酸盐;
(2)次氯酸盐是漂白杀毒剂的有效成分;
(3)漂粉精溶于水后,受空气中的CO2作用,生成次氯酸,次氯酸见光分解(4)漂白粉与浓盐酸制得氯气,发生Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O,贮存很久的漂白粉可能含碳酸钙,结合浓盐酸挥发、气体从溶液中逸出分析.
解答 解:(1)氯气在碱性溶液中自身发生氧化还原反应,与石灰乳反应生成氯化钙、次氯酸钙和水,反应的化学方程式为2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O,
故答案为:2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O;
(2)次氯酸盐是漂白杀毒剂的有效成分是Ca(ClO)2;用于漂白时,在溶液里加少许稀盐酸能促进漂白,有关的化学反应方程式为:Ca(ClO)2+2HCl=CaCl2+2HClO;
故答案为:Ca(ClO)2;盐酸;Ca(ClO)2+2HCl=CaCl2+2HClO;
(3)漂粉精溶于水后,受空气中的CO2作用,生成次氯酸,次氯酸见光分解,反应的化学方程式为:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑;
故答案为:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑;
(4)漂白粉与浓盐酸制得氯气,发生Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O,碳酸钙与盐酸反应生成二氧化碳,因浓盐酸挥发、气体从溶液中逸出,则氯气中一定含二氧化碳和氯化氢,故答案为:二氧化碳和氯化氢.
点评 本题考查了氯气及其化合物的性质应用,主要考查化学方程式的书写和反应原理的理解,题目难度中等.


 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:选择题
| A. | TiCl4是还原剂 | B. | Na被氧化 | ||
| C. | Na得到电子 | D. | TiCl4发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 二甲醚(CH3OCH3)被称为21世界的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
二甲醚(CH3OCH3)被称为21世界的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
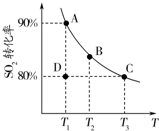 研究硫及其化合物性质有重要意义.
研究硫及其化合物性质有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成的水分子中含有18O | B. | 生成的乙酸乙酯中含有18O | ||
| C. | 可能生成88g乙酸乙酯 | D. | 不可能生成90g乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在混合物中加入足量浓硫酸,加热、过滤 | |
| B. | 在混合物中加入足量NaOH溶液,过滤 | |
| C. | 用磁石将铁粉吸出 | |
| D. | 在混合物中加入足量浓硝酸,加热、过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
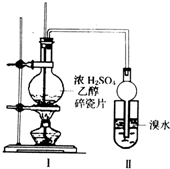 某化学兴趣小组用如图所示装置进行探究实验.以验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色.
某化学兴趣小组用如图所示装置进行探究实验.以验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+的离子结构示意图: | |
| B. | 乙烯的结构简式为:CH2CH2 | |
| C. | 苯分子的结构中没有碳碳单键和碳碳双键,苯分子中的碳碳键是介于它们之间独特的键 | |
| D. | 实验室中用二氧化锰与稀盐酸反应制取Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com