
| 1 |
| 2 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积 (mol2?L-2) | 1×10-14 | a | 1×10-12 |
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 铍 | 硼 | 镁 | 铝 | 硅 | 镓 |
| 电负性 | 1.6 | 2.0 | 1.2 | x | 1.8 | 1.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| x |
| 2 |
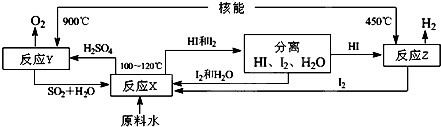
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯酚俗名石炭酸,向苯酚溶液中滴入石蕊试液变浅红色 |
| B、可以用酸性KMnO4鉴别苯和甲苯 |
| C、将金属钠放入乙醇中,反应较缓和且钠浮在液面上 |
| D、苯的同系物中,苯环和侧链相互影响,使得二者均易被氧化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com