
【题目】a、b、c、X是中学化学中常见的四种物质,且a、b、c中含有同一种元素,其转化关系如下图所示。下列说法不正确的是
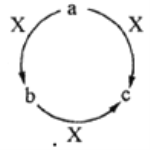
A. 若a、b、c均为厨房中常用的物质,则构成c中的阳离子半径小于其阴离子半径
B. 若a为一种气态氢化物,X为O2,则a分子中可能含有10个或者18个电子
C. 若b为一种两性氢氧化物,则X可能是强酸,也可能是强碱
D. 若a为固态非金属单质,X为O2,则O元素与a元素的原子序数之差可能为8
【答案】D
【解析】若a、b、c均为厨房中常用的物质,a为碳酸钠,X为盐酸,碳酸钠与盐酸反应生成碳酸氢钠b,碳酸氢钠与盐酸继续反应生成氯化钠c,钠离子核外有2个电子层,氯离子核外有有3个电子层,所以氯化钠中阳离子半径小于其阴离子半径,A正确;若a为气态硫化氢,与氧气反应生成单质硫b,硫继续与氧气反应生成二氧化硫c,硫化氢与氧气直接反应生成二氧化硫,硫化氢为18个电子微粒;甲烷与氧气不完全反应生成一氧化碳b,一氧化碳与氧气继续反应生成二氧化碳c,甲烷完全燃烧直接生成二氧化碳,甲烷为10个电子的微粒;综上所述,C正确;若a为单质碳,可以燃烧生成一氧化碳b,二氧化碳c,但是和氧原子序数只差为2,不是8;若a为固态非金属单质硫,与氧气反应不能直接生成三氧化硫c;也就是说,硫原子和氧原子的原子序数虽然能够差8,但是不能满足题意要求,D错误;正确选项D。


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】配合物Na2[Fe(CN)5(NO)]可用于离子检验,下列说法不正确的是
A. 此配合物中存在离子键、配位键、极性键、非极性键
B. 配离子为[Fe(CN)5(NO)]2-,中心离子为Fe3+,配位数为6,配位原子有C和N
C. 1mol配合物中σ键数目为12NA
D. 该配合物为离子化合物,易电离,1mol配合物电离共得到3NA阴阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列4种物质:①Na2O2、②SiO2、③SO2、④NaHCO3固体。其中,
(1)与水反应,生成能使带火星木条复燃的固体是________(填序号);
(2)能使品红溶液褪色且加热时又复原的是_________(填序号);
(3)上述物质中有1种物质难溶于水,该物质在一定条件下与焦炭发生反应,可制得电脑芯片以及太阳能电池的材料,该反应的化学方程式为:_______________________________;
(4)上述物质中有1种物质可以用来除去多余的胃酸,它还是常见的疏松剂,主要是因为它在加热条件下产生了气体,使食品变疏松。写出其受热分解的化学方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,Cl2通入到1L 0.7 mol·L-1的NaOH溶液中,恰好生成NaCl、NaClO、NaClO3,其中生成NaCl和NaClO的物质的量之比为11:1,求:
(1)生成NaClO3的物质的量是___________。
(2)通入的Cl2在标准状况下的体积____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用相关知识填空。
(1)标准状况下,11.2LNH3中含______个氨分子。
(2)等质量的SO2和SO3物质的量之比是______;所含的氧原子个数之比是______。
(3)4.8g CH4中所含氢原子数与______g水所含氢原子数相等。
(4)24.8gNa2R含Na+0.8mol,则Na2R的摩尔质量为______。
(5)标况下,一定量的N2与22.4LCO所含电子的物质的量相等,则N2的质量是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:

(1)从氯化钾溶液中得到氯化钾固体,选择装置______![]()
![]() 填代表装置图的字母,下同
填代表装置图的字母,下同![]()
![]() ;除去自来水中的Cl_等杂质,选择装置______。
;除去自来水中的Cl_等杂质,选择装置______。
(2)从碘水中分离出I2的分离方法的名称为______。
(3)装置A中①的名称是______,进水的方向是从______口进水![]() 。
。
(4)海水中蕴藏着丰富的资源,在实验室中取少量海水,进行如下流程的实验:
![]()
粗盐中含Fe3+、Mg2+、Ca2+、SO42-等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:①加入过量的Na2CO3溶液;②加入过量BaCl2的![]() 溶液;③加入过量的NaOH溶液;④调节溶液的pH等于7;⑤溶解;⑥过滤;⑦蒸发。正确的操作顺序是______(填选项字母) 。
溶液;③加入过量的NaOH溶液;④调节溶液的pH等于7;⑤溶解;⑥过滤;⑦蒸发。正确的操作顺序是______(填选项字母) 。
A.⑤②③①⑥④⑦ B.⑤①②③⑥④⑦ C. ⑤②①③④⑥⑦ D.⑤③②①④⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3·5H2O) 俗名“大苏打”。易溶于水,难溶于乙醇,沸点为100℃,酸性或加热条件下易分解。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图:
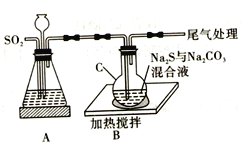
回答下列问题:
(1)装置A可用于观察SO2的生成速率,其中的液体最好选择_____________(填序号)。若装置堵塞使气流不畅,则A中的现象为_______________________________。
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
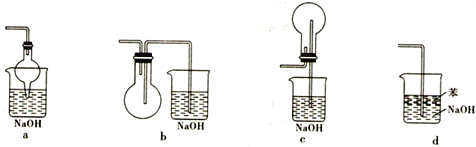
(2)尾气处理可以选择以下装置中的________(填序号)。
(3)反应过程中若pH值小于7则会降低产率,请用离子方程式解释原因:_________________________。
(4)请写出装置C中发生反应的化学方程式:_________________________。
(5)反应结束后,取C中混合物趁热过滤,取滤液于蒸发皿中, ______________,抽滤,洗涤,低温下干燥得产品。洗涤时要尽量减少产品的损失,其具体操作是_________________________。
(6)为检验制得的产品的纯度,该实验小组称取4g 的产品配制成250mL 硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:在锥形瓶中加入20mL 0.0lmol·L-1KIO3溶液,并加入过量的KI并酸化,发生下列反应:5I-+IO3-+6H+=3I2+3H2O,再加入几滴淀粉溶液,立即用所配的Na2S2O3溶液滴定,发生反应:I2+2S2O32-=2I-+ S4O62-,实验数据如下表:
实验序号 | 1 | 2 | 3 |
Na2S2O3溶液体积(mL) | 19.98 | 20.02 | 21.2 |
当滴入最后一滴Na2S2O3溶液时,溶液___________,且半分钟内不变化,则达到终点。计算该产品的纯度是____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com