
【题目】下列有关有机物的说法正确的是
A.C8H10含苯环的烃同分异构体共有3种
B.丙烯酸(CH2COOH)和山梨酸(CH3CH=CHCH=CHCOOH)是同系物
C.油脂在一定条件下水解成高级脂肪酸和甘油,称为皂化反应
D.青蒿素是抗疟疾特效药,其结构如图所示 有酯基、过氧键和醚键,不溶于水,易溶于氯仿、丙酮等,可以用乙醚从植物中提取,能够发生水解反应,具有强氧化性
有酯基、过氧键和醚键,不溶于水,易溶于氯仿、丙酮等,可以用乙醚从植物中提取,能够发生水解反应,具有强氧化性
科目:高中化学 来源: 题型:
【题目】在硝酸铝和硝酸镁的混合溶液中,逐滴加入稀氢氧化钠溶液,直至过量。下列表示氢氧化钠加入量(x)与溶液中沉淀物的量(y)的关系示意图正确的是( )

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过硫酸钾( )具有强氧化性(常被还原为硫酸钾),80℃以上易发生分解。实验室模拟工业合成过硫酸钾的流程如下:
)具有强氧化性(常被还原为硫酸钾),80℃以上易发生分解。实验室模拟工业合成过硫酸钾的流程如下:

(1)硫酸铵和硫酸配制成电解液,以铂作电极进行电解,生成过硫酸铵溶液。写出电解时发生反应的离子方程式___________________。
(2)已知相关物质的溶解度曲线如下图所示。在实验室中提纯过硫酸钾粗产品的实验具体操作依次为:将过硫酸钾粗产品溶于适量水中,___________,干燥。

(3)样品中过硫酸钾的含量可用碘量法进行测定。实验步骤如下:
步骤1:称取过硫酸钾样品0.3000g于碘量瓶中,加入30 mL水溶解。
步骤2:向溶液中加入4.000g KI固体(略过量),摇匀,在暗处放置30 min。
步骤3:在碘量瓶中加入适量醋酸溶液酸化,以淀粉溶液作指示剂,用0.1000mol·L-1Na2S2O3标准溶液滴定至终点,共消耗Na2S2O3标准溶液21.00mL。
(已知反应:I2+2S2O32-=2I-+S4O62-)
①若步骤2中未将碘量瓶“在暗处放置30 min”,立即进行步骤3,则测定的结果可能__________(选填“偏大”、“偏小”、“无影响”);上述步骤3中滴定终点的现象是__________。
②根据上述步骤可计算出该样品中过硫酸钾的质量分数为__________。
③为确保实验结果的准确性,你认为还需要____________________。
(4)将0.40mol过硫酸钾与0.20mol硫酸配制成1 L溶液,在80℃条件下加热并在t时刻向溶液中滴加入少量FeCl3溶液,测定溶液中各成分的浓度如图所示(H+浓度未画出)。图中物质X的化学式为
__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。下列说法正确的是

A.X是电源的正极
B.阳极的反应式是:4OH--4e-=2H2O+O2↑
C.总反应可表示为:H2O+CO2=H2+CO+O2
D.阴、阳两极生成的气体的物质的量之比是1︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有等物质的量浓度的NaBr、KI、NaCl的混合液中通入足量的氯气,充分反应后将溶液蒸干,并灼烧所得的固体,最后剩余的固体成分可能是( )
A.KCl、Br2
B.NaCl、KCl
C.KI、NaCl
D.NaCl、KCl、I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于胶体的叙述中,错误的是
A.胶体的本质特征是其分散质粒子直径为1-100nm
B.胶体是胶状的纯净化合物
C.利用丁达尔效应可区分溶液和胶体
D.将饱和FeCl3(aq)滴入沸水中,再煮沸可形成红褐色的胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】该同学用如下装置进行实验,分析影响反应速率的因素:
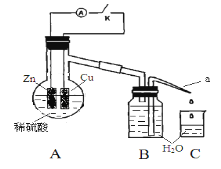
实验时,从断开K开始,每间隔1分钟,交替断开或闭合K,并连续计数每1分钟内从a管流出的水滴数,得到的水滴数如下表所示。下列说法不正确的是
实验Ⅰ(断开K)1分钟水滴数 | 34 | 59 | 86 | 117 | … | 102 |
实验Ⅱ(闭合K))1分钟水滴数 | 58 | 81 | 112 | 139 | … | 78 |
A. 实验Ⅰ中化学能主要转化为热能
B. 实验Ⅱ中化学能主要转化为电能
C. 反应前期水滴数58>34、81>59,主要原因是实验Ⅱ中形成原电池加快反应速率
D. 反应后期水滴数102>78,主要原因是实验Ⅰ溶液温度高于实验Ⅱ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2![]() 2NO+O2在恒容密闭容器中进行,达到平衡状态的是( )
2NO+O2在恒容密闭容器中进行,达到平衡状态的是( )
①单位时间内生成n mol O2的同时生成2n mol NO2②单位时间内生成n mol O2的同时生成2n mol NO ③用NO2、NO、O2的物质的量浓度变化表示的反应速率之比为2∶2∶1的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态 ⑥混合气体的平均相对分子质量不再改变的状态
A. ①④⑤ B. ②③⑤
C. ①④⑥ D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应在任何温度下均能自发进行的是
A. 2N2(g)+O2(g)===2N2O(g) ΔH=+163 kJ·mol-1
B. Ag(s)+Cl2(g)===AgCl(s) ΔH=-127 kJ·mol-1
C. HgO(s)===Hg(l)+O2(g) ΔH=+91 kJ·mol-1
D. H2O2(l)===O2(g)+H2O(l) ΔH=-98 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com