
下列应用不涉及氧化还原反应的是( )
A. Na2O2用作呼吸面具的供氧剂
B.工业上电解熔融状态的Al2O3制备Al
C.工业上利用合成氨实现人工固氮
D.实验室用NH4Cl和Ca(OH)2制备NH3
科目:高中化学 来源: 题型:
下列实验现象所对应的离子方程式不正确的是
|
| 现 象 | 离子方程式 | |||||
| A |
 | 在空气中放置一段时间后,溶液呈蓝色 | 4H++4I-+O2=2I2+2H2O | ||||
| B |
 | 溶液由浅绿色变为红色 | 2Fe2++Cl2=2Fe3++2Cl- Fe3++3SCN- | ||||
| C |
 | 溶液由黄绿色变为无色 | Cl2+2OH-=Cl-+ClO-+H2O | ||||
| D |
 | 有白色沉淀生成 溶液由红色变为无色 | Ba2++OH-+H++SO42-= BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,在0.2 mol·L-1 Al2(SO4)3溶液中,逐滴加入1.0 mol·L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积的变化曲线如图所示,下列有关说法正确的是( )
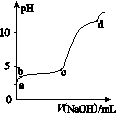
A.a点时,溶液呈酸性的原因是Al3+水解,离子方程式为Al3++3OH- Al(OH)3
Al(OH)3
B.a~b段,溶液pH增大,Al3+浓度不变
C.b~c段,加入的OH-主要用于生成Al(OH)3沉淀
D.d点时,Al(OH)3沉淀开始溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关电解质溶液中粒子浓度关系正确的是( )
A.pH=1的NaHSO4溶液:
c(H+)=c(SO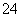 )+c(OH-)
)+c(OH-)
B.含有AgCl和AgI固体的悬浊液:
c(Ag+)>c(Cl-)=c(I-)
C.CO2的水溶液:c(H+)>c(HCO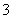 )=2c(CO
)=2c(CO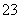 )
)
D.含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O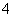 )+c(C2O
)+c(C2O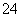 )+c(H2C2O4)]
)+c(H2C2O4)]
查看答案和解析>>
科目:高中化学 来源: 题型:
运用有关概念判断下列叙述正确的是( )
A.1 mol H2燃烧放出的热量为H2的燃烧热
B.Na2SO3与H2O2的反应为氧化还原反应
C.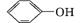 和
和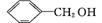 互为同系物
互为同系物
D.BaSO4的水溶液不易导电,故BaSO4是弱电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
NaCl是 一种化工原料,可以制备一系列物质(如图)。下列说法正确的是
一种化工原料,可以制备一系列物质(如图)。下列说法正确的是
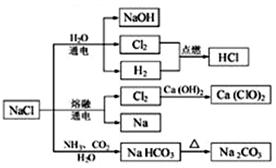
A.25 ℃,NaHCO3在水中的溶解度比Na2CO3的大
B.石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂
C.常温下干燥的Cl2能用钢瓶贮运,所以Cl2不与铁反应
D.如图所示转化反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组在网上收集到如下信息:Fe(NO3)3溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
[实验]制备银镜,并与Fe(NO3)3溶液反应,发现银镜溶解。
(1)下列有关制备银镜过程的说法正确的是 。
a.边振荡盛有2%的AgNO3溶液的试管,边滴入2%的氨水。至最初的沉淀恰好溶解为止
b.将几滴银氨溶液滴入2 mL乙醛中
c.制备银镜时,用酒精灯的外焰给试管底部加热
d.银氨溶液具有较弱的氧化性
e.在银氨溶液配制过程中,溶液的pH增大
[提出假设]
假设1:Fe1+具有氧化性,能氧化Ag。
假设2:Fe(NO3)3溶液显酸性,在此酸性条件下NO3能氧化Ag。
[设计实验方案,验证假设]
(2)甲同学从上述实验的生成物中检验出Fe3+,验证了假设1成立。请写出Fe3+氧化Ag的离子方程式: 。
(3)乙同学设计实验验证假设2,请帮他完成下表中内容(提示: NO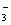 在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
| 实验步骤(不要求写具体操作过程) | 预期现象和结论 |
| ① ② …… | 若银镜消失,假设2成立。 若银镜不消失,假设2不成立。 |
[思考与交流]
(4)甲同学验证了假设1成立,若乙同学验证了假设2也成立。则丙同学由此得出结论:Fe(NO3)3溶液中的Fe3+和NO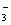 都氧化了Ag。
都氧化了Ag。
你是否同意丙同学的结论,并简述理由: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
氮化铝(AlN,Al和N的相对原子质量分别为27和14)广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C 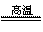 2AlN+3CO合成。下列叙述正确的是( )
2AlN+3CO合成。下列叙述正确的是( )
A.上述反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中,每生成1 mol AlN需转移3 mol电子
C.AlN中氮元素的化合价为+3
D.AlN的摩尔质量为41 g
查看答案和解析>>
科目:高中化学 来源: 题型:
衣康酸M是制备高效除臭剂,粘合剂等多种精细化学品的重要原料,可经下列反应路线得到(部 分反应条件略)。
分反应条件略)。
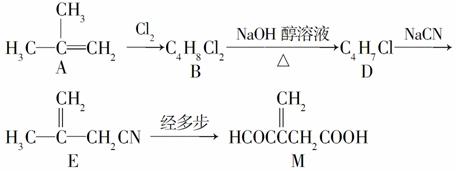
(1)A发生加聚反应的官能团名称是________,所得聚合物分子的结构型式是________(填“线型”或“体型”)。
(2)B→D的化学方程式为_________________________________。
(3)M的同分异构体Q是饱和二元羧酸,则Q的结构简式为________(只写一种)。
(4)已知:—CH2CN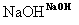 —CH2COONa+NH3,E经五步转变成M的合成反应流程为:
—CH2COONa+NH3,E经五步转变成M的合成反应流程为:
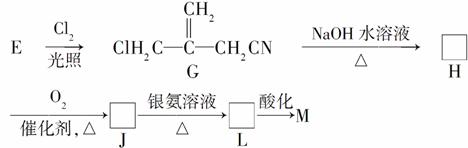
①E→G的化学反应类型为________,G→H的化学方程式为____________________。
②J→L的离子方程式为________________________________。
③已知:-C(OH)3-COOH+H2O,E经三步转变成M的合成反应流程为________________________________________
___________________________________________________________
(示例如上图;第二步反应试剂及条件限用NaOH水溶液、加热)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com