
【题目】向体积为2![]() 的容器中加入1
的容器中加入1![]() N2和6molH2进行可逆反应:N2(g)+3H2(g)
N2和6molH2进行可逆反应:N2(g)+3H2(g)![]() 2NH3(g),2
2NH3(g),2![]() 后测得N2的物质的量为0.6mol,则:
后测得N2的物质的量为0.6mol,则:
(1)2![]() 内,H2的物质的量减少了_______mol,NH3的物质量增加了______mol。
内,H2的物质的量减少了_______mol,NH3的物质量增加了______mol。
(2)若用N2的浓度变化来表示该反应的反应速率为__________mol/(L·min)。
(3)若用NH3的浓度变化来表示该反应的反应速率为_________ mol/(L·min)。
【答案】1.2 0.8 0.1 0.2
【解析】
依据化学平衡的三段式列式计算得到2min后的物质的量,从而计算H2、NH3的物质的量的变化量,根据v=![]() 计算v(N2)和v(NH3)。
计算v(N2)和v(NH3)。
向体积为2L的容器中加入1mol N2和6mol H2进行可逆反应:N2(g)+3H2(g)![]() 2NH3(g),反应2min后,测得N2的物质的量为0.6mol,则
2NH3(g),反应2min后,测得N2的物质的量为0.6mol,则
N2(g)+3H2(g)![]() 2NH3(g),
2NH3(g),
起始量(mol) 1 6 0
变化量(mol) 0.4 1.2 0.8
2![]() (mol) 0.6 4.4 0.8
(mol) 0.6 4.4 0.8
(1)2min内,H2的物质的量减少了1.2mol,NH3的物质的量增加了0.8mol;
(2)用N2的浓度变化来表示该反应的反应速率v(N2)=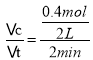 =0.1 mol/(L·min);
=0.1 mol/(L·min);
(3)用NH3的浓度变化来表示该反应的反应速率v(NH3)=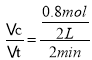 =0.2 mol/(L·min)。
=0.2 mol/(L·min)。


科目:高中化学 来源: 题型:
【题目】能源是人类赖以生存和发展的重要物质基础,常规能源的合理利用和新能源的合理开发是当今人类社会面临的严峻课题。回答下列问题:
(1)我国是世界上少数以煤为主要燃料的国家,下列关于煤作燃料的论点正确的是________。
A.煤是重要的化工原料,把煤作燃料简单燃烧掉太可惜,应该综合利用
B.煤是发热很高的固体燃料,我国煤炭资源相对集中,开采成本低,用煤作燃料实惠
C.煤燃烧时产生大量二氧化硫和烟尘,对环境污染严重
D.通过洁净煤技术,如煤的气化和液化,以及烟气脱硫,不仅减轻了燃煤污染,还能提高煤燃烧的热利用率
(2)乌克兰科学家将铜和铁混合熔化制成多孔金属,用于制作太空火箭上使用的煤油燃料雾化器,该雾化器的作用是_________________________________________________。
(3)乙醇是未来内燃机的首选环保型液体燃料。2.0 g乙醇完全燃烧生成液态水放出59.43 kJ的热量,表示乙醇燃烧热的化学方程式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用下图所示实验装置(部分加持装置已略去)制备无水CuCl2,并对实验过程中污染性气体进行处理。已知CuCl2易潮解。请回答以下问题:
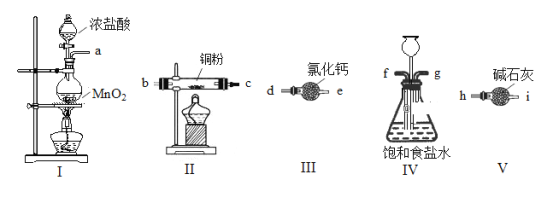
(1)用上图五个装置制取CuCl2,其连接顺序为______________(按气流方向,用小写字母表示)。
(2)装置I中发生反应的离子方程式为_____________________________________。
(3)装置III干燥管中氯化钙的作用是______________________________。
(4)实验开始时,先点燃装置________(填“I”或“II”)处的酒精灯。
(5)本实验中,用如图装置VI代替装置V是否可行______________(填 写“可行”或“不可行”)

(6)实验结束后,先关闭装置I处分液漏斗活塞, 再关闭装置IV的g处(用止水夹夹住),此时装置IV中长颈漏斗的作用是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:

(1)④、⑤、⑥的原子半径由大到小的顺序为___________________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是____________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)_________________。
a.MnO2 b.FeCl3c.Na2SO3d.KMnO4
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
X溶液与Y溶液反应的离子方程式为_____________________,
N→⑥的单质的化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A的产量通常用来衡量一个国家的石油化工水平,现以A为主要原料合成一种具有果香味的物质E,其合成路线如图所示.
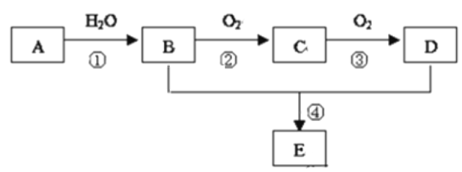
请回答下列问题:
(1)写出A的电子式______________;
(2)D、E分子中官能团的名称是_______、 _________;
(3)写出下列反应的化学方程式:
②_______________________________________,反应类型:____________。
④_______________________________________,反应类型_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是
A. 过氧化钠固体与水反应:2O22-+2H2O=4OH-+O2↑
B. 向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全:2Al3++3SO42-+3Ba2++6OH- =2Al(OH)3↓+3BaSO4↓
C. 用铜做电极电解CuSO4溶液:2Cu2++2H2O![]() 2Cu+O2↑+4H+
2Cu+O2↑+4H+
D. FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+=4Fe3++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬铁矿(FeCr2O4)中含有Al2O3、Fe2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的工艺流程示意图如下(部分操作和条件略):
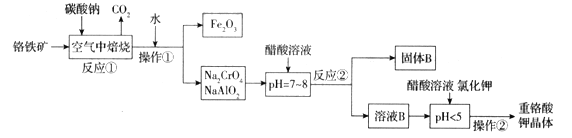
(1)铬铁矿(FeCr2O4)改写为氧化物的形式为___________________。
(2)反应①中发生了两个主要反应,其中一个主要反应的化学方程式为4FeCr2O4+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2;另一个主要反应的化学方程式为 ______________________________。
8Na2CrO4+2Fe2O3+8CO2;另一个主要反应的化学方程式为 ______________________________。
(3)写出反应②中生成固体B的离子方程式为_________________________________。
(4)pH < 5时,发生反应有____________________________________(写离子方程式),Na2Cr2O7 + 2KCl = K2Cr2O7↓+ 2NaCl。
下表是相关物质的溶解度数据:
物质 | 溶解度 ( g / 100 g H2O ) | ||
0℃ | 40℃ | 80℃ | |
KCl | 28 | 40.1 | 51.3 |
NaCl | 35.7 | 36.4 | 38 |
K2Cr2O7 | 4.7 | 26.3 | 73 |
Na2Cr2O7 | 163 | 215 | 376 |
获得K2Cr2O7晶体的操作由多步组成,依次是加入KCl固体、蒸发浓缩、________________、_____________、洗涤、干燥得到晶体。
(5)某种酒精测试仪中,K2Cr2O7在酸性条件下将乙醇氧化为乙酸,自身被还原为三价铬离子,该反应的氧化剂与还原剂的物质的量比为_________________。
(6)含铬废渣(废水)的随意排放对环境有极大危害,电解法是处理铬污染的一种方法,电解时,在阴极区有Fe(OH)3和Cr(OH)3沉淀生成(已知Ksp[Fe(OH)3] = 4.0×10-38,KspCr(OH)3] = 6.0×10-31)。已知电解后的溶液中c(Cr3+)为3.0×10-5mol/L,则溶液中c(Fe3+)为________________ mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1L定容的密闭容器中,可以证明可逆反应N2+3H2![]() 2NH3已达到平衡状态的是
2NH3已达到平衡状态的是
A. c(N2):c(H2):c(NH3)=1:3:2
B. 一个N≡N 断裂的同时,有3个H-H生成
C. 其他条件不变时,混合气体的密度不再改变
D. v正(N2)═2 v逆(NH3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com