
【题目】(12分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:

(1)④、⑤、⑥的原子半径由大到小的顺序为___________________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是____________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)_________________。
a.MnO2 b.FeCl3c.Na2SO3d.KMnO4
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
X溶液与Y溶液反应的离子方程式为_____________________,
N→⑥的单质的化学方程式为________________。
【答案】(1)Na>Al>O (2)HNO3>H2CO3>H2SiO3 (2)![]() (4)a b
(4)a b
(5)Al3++3NH3·H2O2=Al(OH)3↓+3NH4+、2Al2O3![]() 4Al+3O2↑
4Al+3O2↑
【解析】
由元素在周期表中的位置可知:①为H,②为C,③为N,④为O,⑤为Na,⑥为Al,⑦为Si,⑧为Cl。则
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故④、⑤、⑥的原子半径由大到小的顺序是Na>Al>O;
(2)非金属性N>C>Si,元素的非金属性越强,对应的最高价含氧酸的酸性越强,则②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是HNO3>H2CO3>H2SiO3
(3)H、O、Na、Cl中的某些元素可形成既含离子键又含极性共价键的化合物,可以是氢氧化钠或次氯酸钠,其电子式为![]() 或
或![]() ;
;
(4)两种元素的原子按1:1组成的常见液态化合物为H2O2,在MnO2或FeCl3催化作用下分解生成氧气和水,而Na2SO3具有还原性,与H2O2发生氧化还原反应,不能用作催化剂,高锰酸钾具有强氧化性,与H2O2发生氧化还原反应,也不能作催化剂,答案为ab;
(5)M是仅含非金属的盐,所以M一定是铵盐,Z→N→⑥的单质,⑥为Al,推断N是氧化铝,Z是氢氧化铝,根据产物结合反应:X+Y+H2O→Al(OH)3+NH4+可知,该反应为铝盐和一水合氨的反应,因此X溶液与Y溶液反应的离子方程式为Al3++3NH3·H2O=Al(OH)3↓+3NH4+,铝是活泼的金属通过电解法冶炼,则N→⑥的单质的化学方程式为2Al2O3(熔融)![]() 4Al+3O2↑。
4Al+3O2↑。


科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g)![]() C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。

(1)该反应是_________反应(填“吸热”、“放热”)。
(2)反应体系中加入催化剂对反应热是否有影响?___(填“有”、“无”),原因是_______。
(3)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1 _______, E2 ______(填“增大”、“减小”、“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),经过5分钟后,测得D的浓度为0.5mol/L,C的平均反应速率是0.1mol/(L·min),且c(A):c(B)=3:5求:
xC(g)+2D(g),经过5分钟后,测得D的浓度为0.5mol/L,C的平均反应速率是0.1mol/(L·min),且c(A):c(B)=3:5求:
(1)此时A的浓度为______;
(2)反应开始前放入容器中A、B的物质的量是_____________;
(3)B的平均反应速率是_________________;
(4)x值为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g)![]() 2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是( )
2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是( )
A. v(C)=0.8mol·(L·min)-1B. v(B)=0.9mol·(L·min)-1
C. v(A)=0.3mol·(L·min)-1D. v(D)=0.6mol·(L·min)-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1).将一定量纯净的氨基甲酸铵置于密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:H2NCOONH4(s)![]() 2NH3(g)+CO2(g)实验测得不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g)实验测得不同温度下的平衡数据列于下表:
温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡气体总浓度/ (×10-3mol·L-1) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
①氨基甲酸铵分解反应的焓变△H__________0(填">"或"<)
②可以判断该分解反应已经达到化学平衡的是__________(填字母);
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
③根据表中数据,计算25.0℃时的分解平衡常数为__________.
(2).已知25℃时,NH3·H2O电离常数Kb=1.8×10-5,Mg(OH)2的溶度积常数Ksp=1.8×10-11,计算0.5mol·L-1氨水的pH约为__________(已知lg3≈0.5)。在某MgCl2溶液中加入一定量的某浓度的氨水后,测得混合液的pH=11,则此温度下残留在溶液中的c(Mg2+)=__________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向体积为2![]() 的容器中加入1
的容器中加入1![]() N2和6molH2进行可逆反应:N2(g)+3H2(g)
N2和6molH2进行可逆反应:N2(g)+3H2(g)![]() 2NH3(g),2
2NH3(g),2![]() 后测得N2的物质的量为0.6mol,则:
后测得N2的物质的量为0.6mol,则:
(1)2![]() 内,H2的物质的量减少了_______mol,NH3的物质量增加了______mol。
内,H2的物质的量减少了_______mol,NH3的物质量增加了______mol。
(2)若用N2的浓度变化来表示该反应的反应速率为__________mol/(L·min)。
(3)若用NH3的浓度变化来表示该反应的反应速率为_________ mol/(L·min)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用NaI溶液中通入少量Cl2得到含碘废液,再利用含碘废液获取NaI固体,实验流程如下:

已知反应②:2I﹣+2Cu2++![]() +H2O
+H2O![]() 2CuI↓+
2CuI↓+![]() +2H+。
+2H+。
回答下列问题:
(1)过滤实验所需要的玻璃仪器有普通漏斗、烧杯、_____________。
(2)反应③中CuI被氧化,还原产物只有NO2,该反应的化学方程式为_________________。当有95.5 g CuI参与反应,则需要标况下______________L的O2才能将生成的NO2在水中完全转化为硝酸。
(3)化合物B中含两种元素,铁原子与另一种元素原子的物质的量之比为3∶8,则化合物B的化学式为_____________。
(4)反应⑤中生成黑色固体和无色气体,黑色固体的俗称为磁性氧化铁,则反应⑤的化学方程式为______。
(5)将足量的Cl2通入含12 g NaI的溶液中,一段时间后把溶液蒸干得到固体的质量为_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所示的转化关系,回答下列问题:

(1)写出反应①的离子方程式:______________________________________________;写出反应②的离子方程式:______________________。
(2)推出下列物质的化学式:E____________;I______________。
(3)在上述转化过程中,B、C、F、H的氧化能力由弱到强的顺序为______________________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。已知:
CH4(g)+H2O(g) = CO(g)+3H2(g)ΔH=+206.2 kJ/mol
CH4(g)+CO2(g) = 2CO(g)+2H2(g)ΔH=+247.4 kJ/mol
CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为________________________。
(2)电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图见图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为________________________。
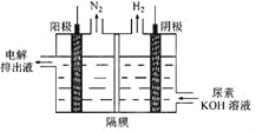
(3) Mg2Cu是一种储氢合金。350℃时,Mg2Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为0.077)。Mg2Cu与H2反应的化学方程式为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com