
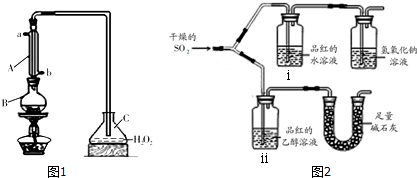
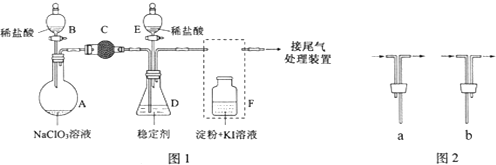
分析 Ⅰ.(1)装置分析仪器A为冷凝管;
(2)仪器B中加入300mL葡萄酒和适量盐酸,加热使SO2全部逸出,并与C中H2O2完全反应,酸性条件下二氧化硫被过氧化氢氧化生成硫酸;
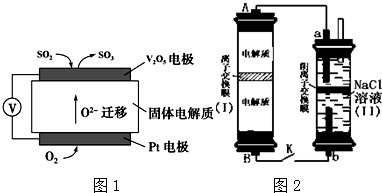
Ⅱ.(1)①实验目的是验证干燥的二氧化硫能否漂白品红,应避免空气中水蒸气加入,SO2对环境有污染,需要尾气处理;
②SO2不能使品红的乙醇溶液褪色,而其水溶液可以,使品红褪色的微粒含有S元素;
③亚硫酸钠和亚硫酸氢钠都能水解生成亚硫酸,且亚硫酸氢根离子能电离生成亚硫酸根离子,所以两种溶液中都含有HSO3-、SO32-、H2SO3;
(2)①铁离子具有强氧化性,在溶液中可以将二氧化硫氧化为硫酸根;利用盐酸酸化的氯化钡溶液检验硫酸根离子;
②混合液中存在平衡FeSO3(s)?Fe2+(aq)+SO32-(aq),Fe3+会与SO32-发生氧化还原反应,使平衡右移,最终生成FeSO4溶液.
解答 解:Ⅰ.(1)装置分析仪器A为冷凝管,
故答案为:冷凝管;
(2)仪器B中加入300mL葡萄酒和适量盐酸,加热使SO2全部逸出,并与C中H2O2完全反应,酸性条件下二氧化硫被过氧化氢氧化生成硫酸,反应的化学方程式为:SO2+H2O2=H2SO4,
故答案为:SO2+H2O2=H2SO4;
Ⅱ.(1)①实验目的是验证干燥的二氧化硫能否漂白品红,应避免空气中水蒸气加入,SO2对环境有污染,需要吸收处理,故碱石灰的作用是防止空气中的水蒸气进入ⅱ中干扰实验,吸收二氧化硫防污染,
故答案为:防止空气中的水蒸气进入ⅱ中干扰实验,吸收二氧化硫防污染;
②SO2不能使口红褪色,而其水溶液可以,因此使品红褪色的微粒可能是H2SO3、HSO3-、SO32-,
故答案为:H2SO3、HSO3-、SO32-;
③亚硫酸钠和亚硫酸氢钠都能水解生成亚硫酸,且亚硫酸氢根离子能电离生成亚硫酸根离子,所以两种溶液中都含有HSO3-、SO32-、H2SO3,所以不能确定使品红褪色的微粒肯定是HSO3-或SO32-,
故答案为:不正确,因为SO32-离子和HSO3-离子都会水解生成H2SO3;
(2)①SO2与FeCl3反应的离子方程式是:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,检验SO42-的方法是:取少量反应混合液,加入盐酸酸化后加氯化钡溶液,产生白色沉淀,混合液中即含有SO42-,
故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;取少量反应混合液,加入盐酸酸化后加氯化钡溶液,产生白色沉淀,混合液中即含有SO42-;
②混合液中存在平衡FeSO3(s)?Fe2+(aq)+SO32-(aq),Fe3+会与SO32-发生氧化还原反应,使平衡右移,墨绿色沉淀溶解,最终生成浅绿色FeSO4溶液,
故答案为:混合液中存在平衡FeSO3(s)?Fe2+(aq)+SO32-(aq),Fe3+会与SO32-发生氧化还原反应,使平衡右移,墨绿色沉淀溶解,最终生成浅绿色FeSO4溶液;
点评 本题考查性质实验方案的设计,侧考查学生对原理的理解分析,熟练掌握元素化合物知识以及对化学反应原理的理解应用,难度中等.


 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径:r(W)>r(Z)>r(Y)>r(X) | |
| B. | 元素Y分别与元素Z、W形成的化合物中化学键类型相同 | |
| C. | 元素Z和元素Y、W均能形成离子化合物 | |
| D. | 四种元素形成的氢化物中,沸点最高的是元素Y的氢化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
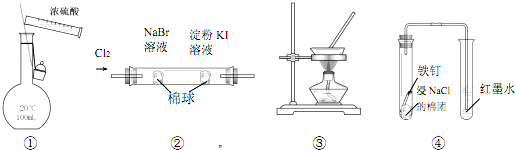
| A. | 图①装置可用于配制 100 mL 0.1 mol/L的硫酸 | |
| B. | 图②装置可证明氧化性:Cl2>Br2>I2 | |
| C. | 图③装置可通过蒸干AlCl3饱和溶液制备AlCl3晶体 | |
| D. | 图④装置可观察铁的吸氧腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:实验题
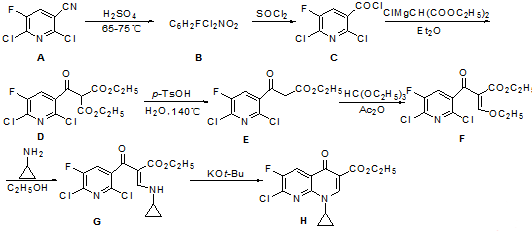
 .由C→D的反应类型是取代反应.
.由C→D的反应类型是取代反应. (其中一种).
(其中一种).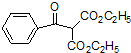 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
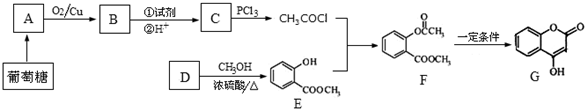
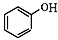 +NaOH→
+NaOH→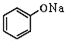 +H2O
+H2O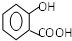 .
. 、CH3COONa、CH3OH.
、CH3COONa、CH3OH.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com