
| A. | 原子半径:r(W)>r(Z)>r(Y)>r(X) | |
| B. | 元素Y分别与元素Z、W形成的化合物中化学键类型相同 | |
| C. | 元素Z和元素Y、W均能形成离子化合物 | |
| D. | 四种元素形成的氢化物中,沸点最高的是元素Y的氢化物 |
分析 短周期主族元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子数的2倍,则X只能含有2个电子层,最外层含有4个电子,为C元素;Z+与Y2-具有相同的电子层结构,再结合原子序数大小可知Z为Na元素、Y为O元素;Y和W同主族,则W为S元素,据此结合元素周期律知识解答.
解答 解:短周期主族元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子数的2倍,则X只能含有2个电子层,最外层含有4个电子,为C元素;Z+与Y2-具有相同的电子层结构,再结合原子序数大小可知Z为Na元素、Y为O元素;Y和W同主族,则W为S元素,
A.电子层越多,原子半径越大,电子层相同时核电荷数越大,原子半径越大,则原子半径大小顺序为:r(Z)>r(W)>r(X)>r(Y),故A错误;
B.Y分别与Z形成的化合物为氧化钠、过氧化钠,含有的化学键为离子键、共价键,Y与W形成的化合物为二氧化硫、三氧化硫,含有的化学键为共价键,含有的化学键类型不同,故B错误;
C.元素Z和元素Y、W形成离子化合物有氧化钠、过氧化钠、硫化钠等,故C正确;
D.碳元素形成的氢化物中,含有碳原子数较多的氢化物沸点较高,常温下为固态,其沸点大于水,故D错误;
故选C.
点评 本题考查原子结构与元素周期律的综合应用,题目难度中等,正确推断元素为解答关键,注意掌握原子结构与元素周期律的关系,试题培养了学生的分析能力及逻辑推理能力


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| W | X | Y | |
| Z |
| A. | 非金属性:Z>Y | |
| B. | 原子的半径:W<X | |
| C. | Z的氧化物能与Y的氢化物反应生成强酸 | |
| D. | Z一种单质熔点为119℃,易溶于二硫化碳,则该单质属于原子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨汽化时吸收大量的热,可用作制冷剂 | |
| B. | 漂白粉和二氧化硫均具有漂白性,将两者混合使用,可增强漂白效果 | |
| C. | 酒精能使蛋白质变性,医院一般用100%的酒精进行消毒 | |
| D. | 氧化铝熔点很高,其制造的坩埚可用于熔融烧碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作及现象 | 结论 | |
| A | 向AgCl悬浊液中加入NaI溶液时出现黄色沉淀. | Ksp(AgCl)<Ksp(AgI) |
| B | 向某溶液中滴加氯水后再加入KSCN溶液,溶液呈红色. | 溶液中一定含有Fe2+ |
| C | 向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色. | Br-还原性强于Cl- |
| D | 加热盛有NH4Cl固体的试管,试管底部固体消失,试管口有晶体凝结. | NH4Cl固体可以升华 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
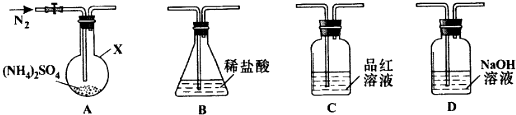
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
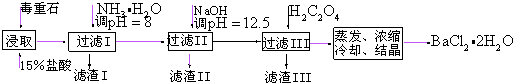
| Ca2+ | Mg2+ | Fe3+ | |
| 开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
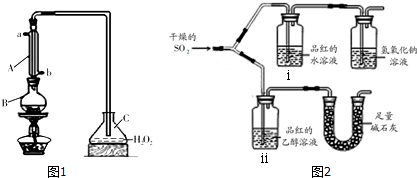
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
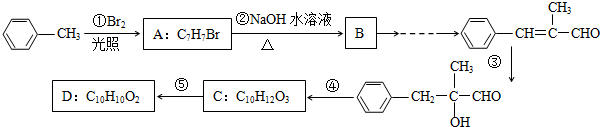

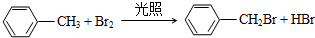 .
. ,无机试剂任选,格式参照图.
,无机试剂任选,格式参照图. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com