


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:单选题
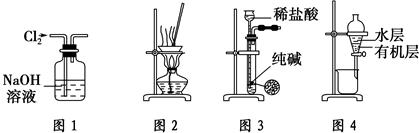
| A.用图1所示装置除去Cl2中含有的少量HCl |
| B.用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
| C.用图3所示装置制取少量纯净的CO2气体 |
| D.用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
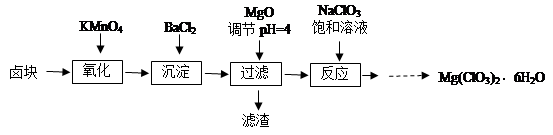
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向某溶液中加入盐酸酸化的BaCl2溶液 | 生成白色沉淀 | 该溶液中一定含有SO42— |
| B | 将少量的溴水滴入FeCl2、NaI的混合溶液中,再滴加CCl4,振荡、静置,向上层溶液中滴加KSCN溶液。再向上层溶液中滴加溴水 | 实验现象1: 上层溶液不变红, 下层溶液紫红色 实验现象2: 上层溶液变红 | 氧化性:Br2>Fe3+>I2 |
| C | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |
| D | BaSO4固体加入饱和Na2CO3溶液中,过滤,向滤渣中加入盐酸 | 有气体生成 | Ksp(BaCO3)<Ksp(BaSO4) |
查看答案和解析>>
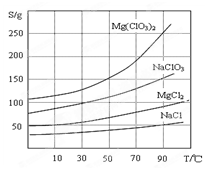
科目:高中化学 来源:不详 题型:填空题
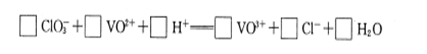
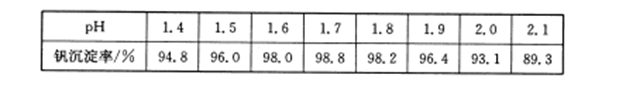
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
| B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 |
| C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D.萃取操作时,在选择萃取剂时,要求萃取剂和原溶剂不互溶 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
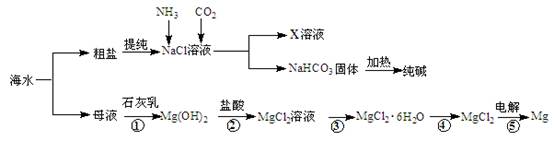
查看答案和解析>>
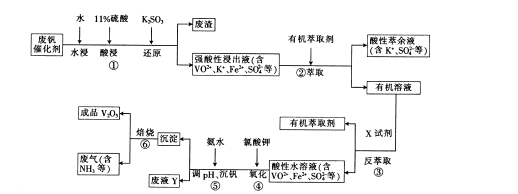
科目:高中化学 来源:不详 题型:填空题
 Cr2O3)冶炼铬,简要流程如下:
Cr2O3)冶炼铬,简要流程如下:
 4Na2CrO4+Fe2O3+4CO2+______________。
4Na2CrO4+Fe2O3+4CO2+______________。
 的硫酸亚铁铵[ (NH4)2Fe(SO4)
的硫酸亚铁铵[ (NH4)2Fe(SO4) ]滴定,终点时消耗b mL(此步骤的目的是用Fe2+把多余的Cr2O72-转化为)Cr3+。
]滴定,终点时消耗b mL(此步骤的目的是用Fe2+把多余的Cr2O72-转化为)Cr3+。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.分液、萃取、蒸馏 | B.萃取、蒸馏、分液 |
| C.分液、蒸馏、萃取 | D.蒸馏、萃取、分液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com