
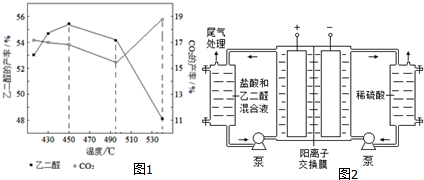
分析 (1)在Cu(NO3)2催化下,用稀硝酸氧化乙醛制取乙二醛,硝酸被还原为NO,其中NO对环境有污染且硝酸有强氧化性;
(2)①已知:Ⅰ.OHC-CHO(g)+2H2(g)?HOCH2CH2OH(g)△H=-78kJ•mol-1 K1
2H2(g)+O2(g)?2H2O(g)△H=-484kJ•mol-1 K2
根据盖斯定律,Ⅱ-Ⅰ可得:HOCH2CH2OH(g)+O2(g)?OHC-CHO(g)+2H2O(g),反应热也进行相应计算,平衡常数为反应Ⅱ与Ⅰ的平衡常数的商;
②主反应HOCH2CH2OH(g)+O2(g)?OHC-CHO(g)+2H2O(g)为放热反应,升高温度平衡逆向移动;温度超过495℃时,乙二醇大量转化为二氧化碳等副产物;
(3)阴极是氢离子放电生成氢气;
(4)阳极液中盐酸的作用,除了产生氯气外,还有增强溶液导电性;
(5)通过总电量为60ta C,再计算电极上通过电子总物质的量;计算生成乙醛的物质的量,根据C元素化合价变化计算消耗电子物质的量,电解中的电流效率;
解答 解:(1)在Cu(NO3)2催化下,用稀硝酸氧化乙醛制取乙二醛,硝酸被还原为NO,反应方程式为:3CH3CHO+4HNO3$\stackrel{Cu(NO_{3})_{2}}{→}$3OHC-CHO+4NO↑+5H2O,生成的NO对环境有污染;
故答案为:3CH3CHO+4HNO3$\stackrel{Cu(NO_{3})_{2}}{→}$3OHC-CHO+4NO↑+5H2O;尾气有污染;
(2)①已知:Ⅰ.OHC-CHO(g)+2H2(g)?HOCH2CH2OH(g)△H=-78kJ•mol-1 K1
Ⅱ.2H2(g)+O2(g)?2H2O(g)△H=-484kJ•mol-1 K2
根据盖斯定律,Ⅱ-Ⅰ可得:HOCH2CH2OH(g)+O2(g)?OHC-CHO(g)+2H2O(g),则△H=-484kJ•mol-1-(-78kJ•mol-1)=-406kJ•mol-1,平衡常数K反应Ⅱ与Ⅰ的平衡常数的商,即K=$\frac{{K}_{2}}{{K}_{1}}$,
故答案为:-406kJ•mol-1;$\frac{{K}_{2}}{{K}_{1}}$;
②主反应HOCH2CH2OH(g)+O2(g)?OHC-CHO(g)+2H2O(g)为放热反应,升高温度平衡逆向移动;温度超过495℃时,乙二醇大量转化为二氧化碳等副产物,使乙二醛产率降低,
故答案为:升高温度,主反应平衡逆向移动;温度超过495℃时,乙二醇大量转化为二氧化碳等副产物;
(3)阴极是氢离子放电生成氢气,电极反应式为:2H++2e-=H2↑,
故答案为:2H++2e-=H2↑;
(4)阳极液中盐酸可以增强溶液导电性,
故答案为:增强溶液导电性;
(5)电极通过总电量为60t s×a A=60ta C,则电极上通过电子总物质的量=$\frac{60ta}{f}$mol;生成乙醛酸的物质的量为74g/mol=$\frac{m}{74}$mol,醛基转化为羧基,C原子化合价升高2价,消耗电子物质的量2×$\frac{m}{74}$mol,故电解中的电流效率η=$\frac{2×\frac{m}{74}mol}{\frac{60ta}{f}}$×100%=$\frac{5mf}{111at}$%,
故答案为:$\frac{5mf}{111at}$%.
点评 本题考查化学平衡常数计算、运用盖斯定律计算反应热、陌生方程式的书写、电极原理应用等,(5)中计算为易错点,关键是确定C元素化合价变化,可以利用碳元素平均化合价计算,注意电子转移守恒在电化学计算中应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | lmolAl3+离子含有的电子数为3NA | |
| B. | 7lgCl2约含有6.02×1023个筑原子 | |
| C. | 58.5g氯化钠固体中,含1 NA个阴离子 | |
| D. | 欲配制1.00L l.00mol/L的NaCl溶液,可将58.5gNaCl溶于1.00L水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用图表示:
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用图表示:
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 2min | 4min | 6nin | 8min | … | |
| CO | 0.07 | 0.06 | 0.06 | 0.05 | … |
| H2 | x | 0.12 | 0.12 | 0.20 | … |
| CH2OH | 0.03 | 0.04 | 0.04 | 0.05 | … |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温下用焦炭还原SiO2制取粗硅 | |
| B. | 晶体硅熔点高硬度大,因此可用于制作半导体材料 | |
| C. | 石英只能用于生产光导纤维 | |
| D. | 玻璃容器可长期盛放各种酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com