
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,2.24 LCCl4中含氯原子数目为0.4NA
B. 1 mol羟基(-OH)中含电子的数目为10NA
C. 1mol苯乙烯(![]() )中含碳碳双键数为4NA
)中含碳碳双键数为4NA
D. 2.8g乙烯和环丙烷的混合气体中含原子总数为0.6NA
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A.1molN2与4molH2充分反应生成的NH3分子数为2NA
B.1molNa218O2与足量CO2完全反应时生成碳酸钠的质量为106g
C.标准状况下,22.4LCHCl3含有的C—Cl键数为3NA
D.18g18O2中含有的中子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释实验事实的方程式不正确的是( )
A.用Na2S处理含Hg2+的废水:Hg2++S2-=HgS↓
B.向沸水中滴加饱和氯化铁溶液得到红褐色液体:FeCl3+3H2O=Fe(OH)3(胶体)+3HCl
C.向Mg(OH)2悬浊液中滴加足量FeCl3溶液出现红褐色沉淀:3Mg(OH)2+2FeCl3=2Fe(OH)3+3MgCl2
D.Na2O2加入H218O中:2Na2O2+2H2l8O=4Na++4OH-+18O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列装置制取溴苯,下列说法不正确的是( )
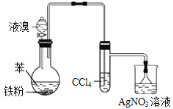
A. 该装置中CCl4的作用是除去产物HBr中混有的Br2蒸气
B. 若将液溴改为浓溴水,该反应也能进行
C. 通过AgNO3溶液中有淡黄色沉淀产生,说明由苯制溴苯的反应是取代反应
D. 该装置中左侧长导管的作用是导气兼冷凝回流
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定Cl2、Br2的氧化性强弱,设计了如下实验:(可供选择的试剂有:氯水、溴水、NaCl溶液、NaBr溶液、酒精、四氯化碳)。实验步骤如图,填写图中的空白。
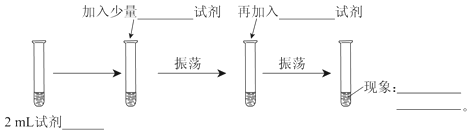
(1)2mL试剂___;
(2)加入少量___试剂;
(3)再加入___试剂;
(4)现象___。
(5)可以证明Cl2的氧化性___(填强于、弱于)Br2的氧化性。
(6)发生反应的离子反应方程式为___。
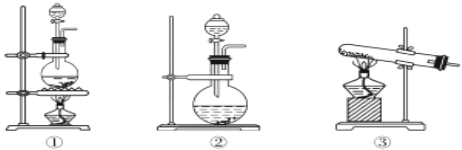
(7)实验室制取氯气用下面装置___(用①②③填写),试着写出制取氯气的反应方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锌是一种重要的工业原料,广泛用于农业、化工等行业。工业上由锌渣(主要成分为ZnO、FeO、CuO、CaO、SiO2)为原料生产ZnSO4·7H2O的流程如图:
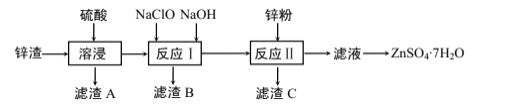
(1)“滤渣A”的主要成分是__。
(2) “反应Ⅰ”中,先加入NaClO反应的离子方程式为__。
(3) “反应Ⅰ”中,再加入NaOH调节合适的pH,则“滤渣B”的主要成分是__(填化学式)。
(4) “反应Ⅱ”中,加入的锌粉需用少量稀硫酸处理,原因是__。
(5)已知ZnSO4溶液的溶解度随温度变化如图,从“滤液”中分离出ZnSO4·7H2O,涉及以下操作:a.在60℃蒸发溶剂;b.蒸发至溶液出现晶膜,停止加热;c.在100℃蒸发溶剂;d.冷却至室温;e.过滤。以上操作的正确顺序为:__(操作可重复使用)。
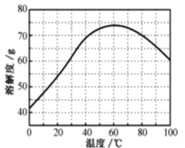
(6)取28.7g ZnSO4·7H2O加热至不同温度,剩余固体的质量如下表:
温度/℃ | 100 | 250 | 680 | 930 |
质量/g | 17.90 | 16.10 | 13.43 | 8.10 |
则680℃时所得固体的化学式为___(填字母标号)。
a.ZnSO4·H2O b.ZnSO4c.Zn3O(SO4)2d.ZnO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸亚乙酯是一种重要的添加剂,结构如图(![]() ),碳酸亚乙酯可由环氧乙烷与二氧化碳反应而得,亦可由碳酸与乙二醇反应获得。下列说法正确的是
),碳酸亚乙酯可由环氧乙烷与二氧化碳反应而得,亦可由碳酸与乙二醇反应获得。下列说法正确的是
A.上述两种制备反应类型相同
B.碳酸亚乙酯的分子式为C3H6O3
C.碳酸亚乙酯中所有原子可能共平面
D.碳酸亚乙酯保存时应避免与碱接触
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究化学反应时,既要考虑物质变化与能量变化,又要关注反应的快慢与限度。回答下列问题:
(1)NH3还原NO是重要的烟气脱硝技术,其反应过程与能量关系如图所示
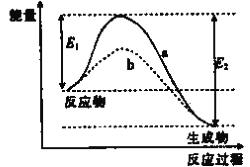
①上图中因为改变了反应条件,反应的活化能:b_______(填“>”“<"或“=”)a。
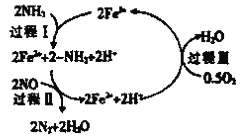
②脱硝反应的热化学方程式可表示为反应物→生成物△H=______(用E1、E2的代数式表示)。
③研究发现,一定条件下的脱硝反应过程可能如图所示,根据氧化还原反应中物质的作用,NO为_______剂,脱硝总反应的化学方程式为_______________。
(2)一定温度下,将不同物质的量的H2O(g)和CO分别通入容积为1L的恒容密容器中,进行反应H2O(g)+CO(g)![]() CO2(g)+H2(g),得到如表所示的三组数据
CO2(g)+H2(g),得到如表所示的三组数据
试验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡时间/min | ||
H2O(g) | CO(g) | CO(g) | H2(g) | |||
1 | 650 | 2.0 | 4.0 | 3.0 | 1.0 | 5 |
2 | 900 | 1.0 | 2.0 | 1.8 | 0.2 | 4 |
3 | 900 | a | b | c | d | t |
①4mim内,实验2中v(CO2)=______; 900℃时,反应的平衡常数为______;降低温度时,平衡常数会________(填“增大”“减小”或“不变”)。
②650℃时,若在此容器中充入2.0 mol H2O(g)、1.0molCO(g)、1.0 mol CO2(g)和 xmol H2(g),要使反应在开始时向正反应方向进行,则x应满足的条件是__________。
若a=2.0.b=1.0,则平衡时实验2中H2O(g)和实验3中CO(g)的转化率(a)的关系为a(H2O) _______ (填“>”<”成=”)a(CO)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g),经2min后,测得D的浓度为0.5 molL-1,c(A):c(B)=3:4,C的平均反应速率为0.5 molL-1min-1。求
(1)此时A的浓度c(A)=_____molL-1,反应开始前容器中的A、B的物质的量:n(A)=n(B)=_______mol。
(2)B的平均反应速率ν(B)=_______molL-1min-1。
(3)x的值为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com