
【题目】硫酸锌是一种重要的工业原料,广泛用于农业、化工等行业。工业上由锌渣(主要成分为ZnO、FeO、CuO、CaO、SiO2)为原料生产ZnSO4·7H2O的流程如图:
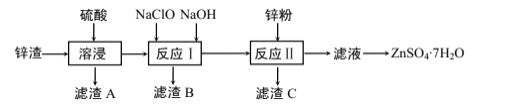
(1)“滤渣A”的主要成分是__。
(2) “反应Ⅰ”中,先加入NaClO反应的离子方程式为__。
(3) “反应Ⅰ”中,再加入NaOH调节合适的pH,则“滤渣B”的主要成分是__(填化学式)。
(4) “反应Ⅱ”中,加入的锌粉需用少量稀硫酸处理,原因是__。
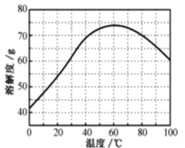
(5)已知ZnSO4溶液的溶解度随温度变化如图,从“滤液”中分离出ZnSO4·7H2O,涉及以下操作:a.在60℃蒸发溶剂;b.蒸发至溶液出现晶膜,停止加热;c.在100℃蒸发溶剂;d.冷却至室温;e.过滤。以上操作的正确顺序为:__(操作可重复使用)。
(6)取28.7g ZnSO4·7H2O加热至不同温度,剩余固体的质量如下表:
温度/℃ | 100 | 250 | 680 | 930 |
质量/g | 17.90 | 16.10 | 13.43 | 8.10 |
则680℃时所得固体的化学式为___(填字母标号)。
a.ZnSO4·H2O b.ZnSO4c.Zn3O(SO4)2d.ZnO
【答案】SiO2、CaSO4 2Fe2++ClO-+2H+=2Fe3++Cl-+H2O Fe(OH)3 除去锌粉表面的氧化膜 cbabde c
【解析】
工业上往锌渣(主要成分为ZnO、FeO、CuO、CaO、SiO2)中加入硫酸,ZnO、FeO、CuO完全溶解转化为硫酸盐,CaO与硫酸反应转化为CaSO4沉淀,SiO2不反应,CaSO4、SiO2成为滤渣A;往滤液中加入NaClO,此时Fe2+被氧化为Fe3+,再加入NaOH溶液,Fe3+转化为Fe(OH)3,并成为滤渣B;再往滤液中加入锌粉,将溶液中的Cu2+还原为Cu;滤液经过蒸发结晶,便得到ZnSO4·7H2O晶体。
(1)由以上分析知,“滤渣A”的主要成分是SiO2、CaSO4;答案为:SiO2、CaSO4;
(2) “反应Ⅰ”中,先加入NaClO,将Fe2+氧化为Fe3+,此时溶液呈酸性,ClO-被还原为Cl-,反应的离子方程式为2Fe2++ClO-+2H+=2Fe3++Cl-+H2O;答案为:2Fe2++ClO-+2H+=2Fe3++Cl-+H2O;
(3) “反应Ⅰ”中,再加入NaOH调节合适的pH,此时Fe3+与OH-反应生成Fe(OH)3,则“滤渣B”的主要成分是Fe(OH)3;答案为:Fe(OH)3;
(4) “反应Ⅱ”中,发生的是Zn与Cu2+的置换反应,加入的锌粉需用少量稀硫酸处理,则稀硫酸应处理锌,以有利于锌与Cu2+的反应,原因是除去锌粉表面的氧化膜;答案为:除去锌粉表面的氧化膜;
(5)从图中可以看出,60℃前,ZnSO4的溶解度随温度升高而增大,60℃后,ZnSO4的溶解度随温度升高而减小。为便于蒸发水分,起初温度应控制在100℃,加热蒸发到溶液饱和时,再降温至60℃,再次蒸发水分,至饱和后,降低温度,获得晶体。由此可确定以上操作的正确顺序为:cbabde;答案为:cbabde;
(6)28.7g ZnSO4·7H2O,物质的量为![]() =0.1mol,100℃时,固体物质的摩尔质量为
=0.1mol,100℃时,固体物质的摩尔质量为![]() =179g/mol,其为ZnSO4·H2O;250℃时,固体物质的摩尔质量为
=179g/mol,其为ZnSO4·H2O;250℃时,固体物质的摩尔质量为![]() =161g/mol,其为ZnSO4;930℃时,固体物质的摩尔质量为
=161g/mol,其为ZnSO4;930℃时,固体物质的摩尔质量为![]() =81g/mol,其为ZnO;所以680℃时,固体为Zn3O(SO4)2;答案为:Zn3O(SO4)2。
=81g/mol,其为ZnO;所以680℃时,固体为Zn3O(SO4)2;答案为:Zn3O(SO4)2。


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】在25℃时,某稀溶液中由水电离产生的c(OH-)=10-10molL-1.下列有关该溶液的叙述正确的是( )
A. 该溶液一定呈酸性
B. 该溶液中![]() 可能等于
可能等于![]()
![]()
C. 该溶液的pH可能为4也可能为10
D. 该溶液有可能呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,铁有δ、γ、α三种同素异形体,三种晶体在不同温度下能发生转化。下列说法正确的是 ( )
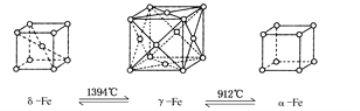
A. γ-Fe晶体中与每个铁原子距离相等且最近的铁原子有6个
B. α-Fe晶体中与每个铁原子距离相等且最近的铁原子有6个
C. 将铁加热到1 500 ℃分别急速冷却和缓慢冷却,得到的晶体类型相同
D. 三种同素异形体的性质相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.字母A~K代表常见物质,在一定条件下能发生如图所示变化。
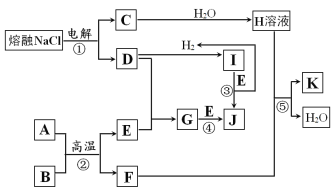
已知:反应②中A为黑色粉末,B为金属单质,且n(A):n(B)=3:2。反应③和④均在水溶液中进行。
(1)写出J的名称:___。
(2)写出反应②的化学方程式:___。
(3)写出反应⑤的离子方程式:___。
II.某研究性学习小组的同学以Fe(NO3)3溶液来探究Fe3+能否氧化Ag为题。他们选用少量的Fe(NO3)3溶液与做过银镜反应的试管进行实验。现象:银镜部分溶解,试管上方出现少量淡淡的红棕色气体。
请你判断:以上实验能否得到相关结论。
若你认为能得出结论,请简述理由:___。
若你认为不能得出结论,请在此实验基础上,再继续实验(试剂任选),直至得出相关结论。请设计实验(写出实验操作、现象和结论):___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,2.24 LCCl4中含氯原子数目为0.4NA
B. 1 mol羟基(-OH)中含电子的数目为10NA
C. 1mol苯乙烯(![]() )中含碳碳双键数为4NA
)中含碳碳双键数为4NA
D. 2.8g乙烯和环丙烷的混合气体中含原子总数为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.己烷有5种同分异构体(不考虑立体异构),它们的熔点、沸点各不相同
B.苯的密度比水小,但由苯反应制得的溴苯、硝基苯的密度都比水大
C.聚合物(![]() )可由单体CH3CH=CH2和CH2=CH2加聚制得
)可由单体CH3CH=CH2和CH2=CH2加聚制得
D.1 mol葡萄糖能水解生成2 mol CH3CH2OH和2 mol CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷能形成众多单质与化合物。回答下列问题:
(1)磷在成键时,能将一个3s电子激发进入3d能级而参加成键,写出该激发态原子的核外电子排布式__ 。
(2)黑磷是一种二维材料,其中一层的结构如图1所示。
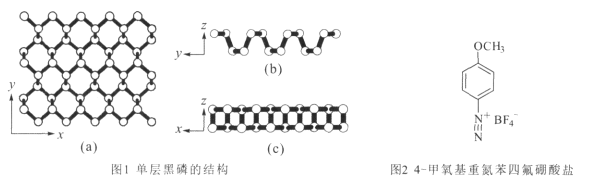
①黑磷中P原子的杂化方式为 _________ 。每一层内P形成六元环彼此相接,平均每个空间六元环中含有的磷原子是 ____个。
②用4-甲氧基重氮苯四氟硼酸盐(如图2)处理黑磷纳米材料,可以保护和控制其性质。
该盐的构成元素中C、N、O、F的电负性由大到小顺序为__,1mol该盐阳离子含有的σ键的数目为______ ,该盐阴离子的几何构型是__。
(3)磷钇矿可提取稀土元素钇(Y),某磷钇矿的结构如下:

该磷钇矿的化学式为__,与PO43—互为等电子体的阴离子有__ (写出两种离子的化学式)。已知晶胞参数a= 0.69 nm,c=0.60 nm,阿伏加德罗常数为NA,则该磷钇矿的密度为__g.cm—3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关实验室制乙烯的说法中,不正确的是 ( )
A. 温度计应伸入反应物的液面以下
B. 要向烧瓶中加入碎瓷片,以防液体受热产生暴沸
C. 乙烯气体中可能混有SO2、CO2杂质,需进一步净化处理
D. 加热要缓慢,使温度逐渐上升至170℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学实验”已走进课堂,下列做法符合“绿色化学”的是

①实验室收集氨气采用图1所示装置
②实验室做氯气与钠的反应实验时采用图2所示装置
③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验
④实验室中采用图3所示装置进行铜与稀硝酸的反应
A. ②③④B. ①②③C. ①②④D. ①③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com