
 (1)1s22s22p63s23p63d9 (3分) (2)孤对电子(孤电子对) (3分)
(1)1s22s22p63s23p63d9 (3分) (2)孤对电子(孤电子对) (3分)

 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案科目:高中化学 来源:不详 题型:单选题
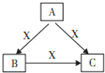
| A.若A为AlCl3,则X可能为KOH溶液 |
| B.若X为O2,A可能是S等 |
| C.若X可能为Fe,则C可能为Fe(NO3)2溶液 |
| D.A也有可能是Na |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Li、Na、K元素的原子核外电子层数随着核电荷数的增加而减少 |
| B.第二周期元素从Li到F,非金属性逐渐减弱 |
| C.因为K比Na容易失去电子,所以K比Na的还原性强 |
| D.O与S为同主族元素,且O比S的非金属性弱 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素编号 | 元素性质或原子结构 |
| A | A原子所处的周期数、族序数、原子序数均相等 |
| B | 核外电子有6种不同运动状态 |
| C | 最简单氢化物的水溶液呈碱性 |
| D | 基态原子的S轨道电子数等于P轨道电子数 |
 所得ABCD的结构式为________,分子中C原子的杂化类型是______________。
所得ABCD的结构式为________,分子中C原子的杂化类型是______________。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | | ||||||
| 2 | | | | D | E | K | G | |
| 3 | B | | C | J | F | | H | I |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com