
| A����֪2H2(g)��O2(g)===2H2O(g)����H����483��6 kJ��mol��1����������ȼ����Ϊ241��8 kJ��mol��1 |
| B����֪NaOH(aq)��HCl(aq)===NaCl(aq)��H2O(l)����H����57��3 kJ��mol��1����40��0 g NaOH��ϡ��Һ��ϡ������ȫ�кͣ��ų�57��3 kJ������ |
| C����֪2C(s)��2O2(g)===2CO2(g)����H��a��2C(s)��O2(g)===2CO(g)����H��b����a>b |
| D����֪C(ʯī��s)===C(���ʯ��s)����H>0����ʯī�Ƚ��ʯ�ȶ� |


 ������ϰ�ο����뵥Ԫ���ϵ�д�
������ϰ�ο����뵥Ԫ���ϵ�д� �����Ծ���ĩ���100��ϵ�д�
�����Ծ���ĩ���100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 NH4++NH2����ij�¶��������ӻ�����Ϊ1��10��30��mol��L��1��2��Һ���е�pNH4��ˮ�е�pH���ƣ���1LҺ���м���2.3gNa��ʱ����ƽ��____________�ƶ���������������淽����������ȫ��Ӧ����Һ��pNH4=__________��
NH4++NH2����ij�¶��������ӻ�����Ϊ1��10��30��mol��L��1��2��Һ���е�pNH4��ˮ�е�pH���ƣ���1LҺ���м���2.3gNa��ʱ����ƽ��____________�ƶ���������������淽����������ȫ��Ӧ����Һ��pNH4=__________���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���кͷ�Ӧ�����ȷ�Ӧ |
| B��ȼ���Ƿ��ȷ�Ӧ |
| C����ѧ�����ѷų����� |
| D����Ӧ����������������������һ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
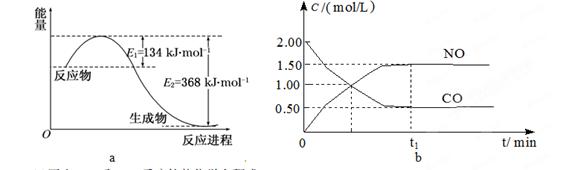
| �� �� | �� | �� | �� |
| ��Ӧ��Ͷ���� | 1 mol NO2 1 mol CO | 2 mol NO 2 mol CO2 | 1 mol NO2��1 mol CO 1 mol NO��1 mol CO2 |
| ƽ��ʱc(NO) /mol��L-1 | 1.5 | 3 | m |
| �����仯 | �ų�a kJ | ����b kJ | �ų�c kJ |
| CO��NO��ת���� | ��1 | ��2 | ��3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��Һ̬ˮ���� | B�����������ȱ�Ϊ��ɫ��ĩ | C��Ũ����ϡ�� | D������������ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������91��5kJ | B������183kJ | C������183kJ | D������91��5kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ��ʴ���
| ���� | H2(g) | Br2(g) | HBr(g) |
| 1 mol�����л�ѧ������ʱ��Ҫ���յ�����/kJ | 436 | 200 | 369 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CH3OH(g)�����ܱ������г���10 mol CO��20 mol H2��CO��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��ʾ��
CH3OH(g)�����ܱ������г���10 mol CO��20 mol H2��CO��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��ʾ��
 ��ԭΪN2��һ��ʱ�����Һ�ļ���
��ԭΪN2��һ��ʱ�����Һ�ļ��� ��ԭ����ͼ��ʾ����Դ����Ϊ ���a����b������
��ԭ����ͼ��ʾ����Դ����Ϊ ���a����b������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com