
| A. | 1mol CO2和1mol CO所占的体积相同,所含分子数相同 | |
| B. | 1g CO和1g CO2所占的体积不同,所含分子数不同 | |
| C. | 在任何情况下,1mol CO2和64g SO2所含有分子数和原子总数都相同 | |
| D. | 某物质若含阿伏加德罗常数个微粒,该物质在标准状况下体积约为22.4L |
分析 A、根据N=nNA可知,物质的量相等,含有的分子数一定相等;在同温同压下,气体摩尔体积相同,根据V=Vm可知,相同物质的量的气体具有相同的体积,题中没有告诉压强和温度,无法确定1mol CO2和1mol CO的体积是否相等;
B、根据n=$\frac{m}{M}$,而两者的摩尔质量不等;
C、64g SO2的物质的量为1mol;
D、状态不知.
解答 解:A、1mol CO2和1mol CO含有的分子数为:N=1×NA=NA,所以二者含有相同的分子数;由于温度和压强影响气体的体积,题中没有告诉温度和压强,无法判断1mol CO2和1mol CO的体积是否相等,故A错误;
B、根据n=$\frac{m}{M}$,而两者的摩尔质量不等,所以两者的物质的量不等,所含分子数不同,而状态不知,体积不能确定,故B错误;
C、64g SO2的物质的量为1mol,所以在任何情况下,1mol CO2和64g SO2所含有分子数和原子总数都相同,故C正确;
D、状态不知,必需是气体物质,故D错误;
故选C.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意温度和压强能够影响气体的体积,要求学生掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,要准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.


科目:高中化学 来源: 题型:选择题
 某电解装置如图所示,电解槽内装有淀粉KI溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现右侧溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH-═IO3-+5I-+3H2O.下列说法不正确的是( )
某电解装置如图所示,电解槽内装有淀粉KI溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现右侧溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH-═IO3-+5I-+3H2O.下列说法不正确的是( )| A. | 石墨电极与电源的正极相连 | |
| B. | 刚开始电解时,左侧溶液的pH增大 | |
| C. | 电解结束时,右侧溶液中含有I- | |
| D. | 电解槽内发生反应的总化学方程式为2KI+2H2O═I2+H2↑+2KOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下与足量18mol/LH2SO4反应,最多可放出0.6molH2 | |
| B. | 常温下与足量2mol/LHNO3反应,最少可放出0.45molH2 | |
| C. | 常温下与足量2mol/LH2SO4反应,放出H2的量在0.45mol~0.6mol之间 | |
| D. | 常温下与足量2mol/LNaOH反应,放出H2的量在0.45mol~0.6mol之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解时以纯铜作阳极 | |
| B. | 电解时阳极发生还原反应 | |
| C. | 纯铜连接电源负极,电极反应是Cu-2e-=Cu2+ | |
| D. | 电解后,电解槽底部会形成含少量Ag、Au等金属阳极泥 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
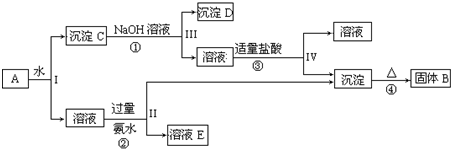
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 1 mol X最多能与4 mol H2发生加成反应 | |
| B. | 在Y分子中只含有1个手性碳原子 | |
| C. | X、Y均可以与NaOH溶液发生反应 | |
| D. | Y能发生加成、取代、消去、水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
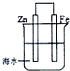
| A. | 此装置属于电解池 | |
| B. | 此装置中的铁做正极,发生氧化反应 | |
| C. | 此装置中电子从锌极流向铁极 | |
| D. | 此装置中的锌做阴极,极反应为:Zn-2e→Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 18gNH4+中含有的电子数为11NA | |
| B. | 12g石墨中含有的共价键数为1.5NA | |
| C. | 标准状况下,22.4LNO2和CO2混合物中含有原子总数为3NA | |
| D. | 1 mol Na与足量O2反应,生成 Na2O和Na2O2的混合物,钠失去NA个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com