
【题目】在容积不变的密闭容器中有如下反应:2SO2(g)+O2 (g)![]() 2 SO3(g);△H<0。某研究小组进行了当其他条件不变时,改变某一条件对上述反应影响的研究,下列分析正确的是
2 SO3(g);△H<0。某研究小组进行了当其他条件不变时,改变某一条件对上述反应影响的研究,下列分析正确的是

①图Ⅰ研究的是温度对化学平衡的影响,且乙的温度较高
②图Ⅱ研究的是催化剂对反应速率的影响,化学平衡不移动
③图Ⅱ研究的是t0时刻通入氦气增大体系压强对反应速率的影响
④图Ⅲ研究的是t0时刻增大O2的浓度对反应速率的影响
A. ①②B. ②③C. ②④D. ③④
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
【题目】实验室用固体Na2CO3配制90mL 0.200 mol·L-1的Na2CO3溶液,回答下列问题:
(1)通过计算得出可用天平称取Na2CO3固体________g。
(2)若要实施配制,除天平、烧杯、玻璃棒外,还需的玻璃仪器有 _______ ,______。
(3)溶解过程中,玻璃棒的作用是__________________。
(4)配制完毕后,教师指出有四位同学进行了下列某一项错误操作,你认为这四项错误操作中会导致所得溶液浓度偏低的是____(填选项字母)。
a.定容时俯视容量瓶刻度线
b.转移时未洗涤烧杯和玻璃棒
c.容量瓶使用时未干燥
d.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种绿色氧化剂,具有高效的杀菌消毒作用,常用于饮水处理,在许多领域展现出广阔的应用前景。制备高铁酸钾有下列两种方法:
方法一:Fe2O3 + KNO3 + KOH===== K2FeO4 + KNO2 + H2O (未配平)
方法二:2Fe(OH)3+3KClO+4KOH=2K2FeO4+3KCl+ 5H2O
(1)配平方法一的化学方程式___,再用双线桥标明电子转移的方向和数目___:
___Fe2O3 +___KNO3 +___KOH == ___ K2FeO4 +___ KNO2 +___ H2O
(2)方法二中的还原产物为_________ (写化学式),将方法二的化学方程式改写为离子方程式 ________ ,根据反应方程式,氧化性:KClO ________ K2FeO4(填“>”、“<”或“=”);
(3)利用方法二制备K2FeO4,若有0.5mol K2FeO4生成,转移的电子数为___________ ;
(4)在酸性溶液中,某反应的反应物和生成物有KBiO3、K2SO4、H2SO4、MnSO4、H2O、Bi2(SO4)3 和一种未知物质M。
①已知MnSO4在反应中失去电子,则该反应的氧化剂是________;
②已知该反应中被氧化的元素与被还原的元素的物质的量之比为2:5,则M的化学式为______;
③写出该反应的离子反应方程式________;
④某同学向上述反应后的溶液中逐滴加入FeSO4溶液,测得溶液中M的物质的量与FeSO4的物质的量之间的关系如图所示。已知氧化性:Fe3+>Bi3+,且a点时溶液中含Fe3+、Mn2+,则原反应体系中,起始加入的KBiO3的物质的量为____________。
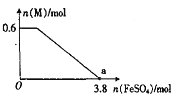
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写不正确的是
A.向小苏打溶液中加入硫酸氢钠溶液:![]()
B.碳酸镁与稀硫酸反应:![]()
C.金属铝溶于盐酸中:![]()
D.向稀硫酸中加入氢氧化钡溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一混合物的水溶液,可能含有以下离子中的几种:![]() 、
、![]() 、
、![]() 、
、![]() 现取三份各100mL溶液进行如下实验:第一份加入
现取三份各100mL溶液进行如下实验:第一份加入![]() 溶液有沉淀A产生:第二份加足量NaOH溶液加热后,收集到0.08ml气体B;第三份加足量
溶液有沉淀A产生:第二份加足量NaOH溶液加热后,收集到0.08ml气体B;第三份加足量![]() 溶液后,得到干燥沉淀C 12.54g,经足量盐酸洗涤干燥后,沉淀质量为4.66g
溶液后,得到干燥沉淀C 12.54g,经足量盐酸洗涤干燥后,沉淀质量为4.66g
请回答以下问题
(1) 沉淀C的成分是_________,其物质的量分别是_____________
(2) 写出产生气体B的离子方程式 ____________________
(3) 该混合液中可能含的离子有___________,一定含有的阳离子有_________其物质的量分别是_____________一定没有的离子是_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,分子数不相同的是
A.同温同压下 2 L SO2 和 2 L CO2
B.标准状况下 1mol 氧气和 22.4 LSO3
C.9g 水和标准状况下 11.2 L CO2
D.0.2mol 氯气和 7.3g 氯化氢气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为1 mol/L KCl、CuCl2、AlCl3三种溶液,分别与AgNO3溶液反应,当生成的AgCl沉淀的质量之比为3︰2︰1时,所用KCl、CuCl2、AlCl3三种溶液的体积比为( )
A. 9︰6︰2 B. 9︰3︰1 C. 6︰3︰2 D. 6︰3︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中,两种气体的分子数一定相等的是 ( )
A. 温度相同、体积相同的O2和N2 B. 体积相等、密度不等的CO和C2H4
C. 质量相等、密度不等的CO和C2H4 D. 压强相同、体积相同的O2和N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温密闭容器中发生反应:CaCO3(s)![]() CaO(s)+CO2(g) H>0,反应达到平衡后,tl时缩小容器体积, x随时间(t)变化的关系如下图所示。x不可能是( )
CaO(s)+CO2(g) H>0,反应达到平衡后,tl时缩小容器体积, x随时间(t)变化的关系如下图所示。x不可能是( )
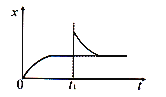
A. υ逆(逆反应速率)B. ρ(容器内气体密度)
C. m(容器内CaO质量)D. p(容器压强)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com