
【题目】现有一混合物的水溶液,可能含有以下离子中的几种:![]() 、
、![]() 、
、![]() 、
、![]() 现取三份各100mL溶液进行如下实验:第一份加入
现取三份各100mL溶液进行如下实验:第一份加入![]() 溶液有沉淀A产生:第二份加足量NaOH溶液加热后,收集到0.08ml气体B;第三份加足量
溶液有沉淀A产生:第二份加足量NaOH溶液加热后,收集到0.08ml气体B;第三份加足量![]() 溶液后,得到干燥沉淀C 12.54g,经足量盐酸洗涤干燥后,沉淀质量为4.66g
溶液后,得到干燥沉淀C 12.54g,经足量盐酸洗涤干燥后,沉淀质量为4.66g
请回答以下问题
(1) 沉淀C的成分是_________,其物质的量分别是_____________
(2) 写出产生气体B的离子方程式 ____________________
(3) 该混合液中可能含的离子有___________,一定含有的阳离子有_________其物质的量分别是_____________一定没有的离子是_________________
【答案】硫酸钡、碳酸钡 ![]()
![]() Cl-
Cl- ![]()
![]()
![]()
【解析】
第一份加入AgNO3溶液有沉淀产生,与AgNO3溶液有沉淀产生,则至少含Cl-、CO32-、SO42-中的一种;
第二份加足量NaOH溶液加热产生气体,气体是氨气,溶液中一定含有NH4+,且物质的量为0.08mol;
第三份加入足量BaCl2溶液后,得到干燥沉淀12.54g,经足量的盐酸洗涤、干燥后,沉淀质量为4.66g,可知不溶于盐酸的4.66g为硫酸钡,物质的量为![]() =0.02mol;12.54g沉淀是硫酸钡和碳酸钡,碳酸钡质量为12.54g-4.66g=7.88g,碳酸钡的物质的量为
=0.02mol;12.54g沉淀是硫酸钡和碳酸钡,碳酸钡质量为12.54g-4.66g=7.88g,碳酸钡的物质的量为![]() =0.04mol,故原溶液中一定存在CO32-、SO42-,则一定没有Ca2+、Ba2+;
=0.04mol,故原溶液中一定存在CO32-、SO42-,则一定没有Ca2+、Ba2+;
由电荷守恒可知,正电荷=n(NH4+)=0.08mol;负电荷=2c(CO32-)+2c(SO42-)=0.12mol,正电荷总物质的量大于负电荷,故原溶液中一定有K+,至少为0.04mol,以此来解答。
(1).第三份加入足量BaCl2溶液后,得到干燥沉淀12.54g,经足量的盐酸洗涤、干燥后,沉淀质量为4.66g,可知不溶于盐酸的4.66g为硫酸钡,物质的量为![]() =0.02mol;12.54g沉淀是硫酸钡和碳酸钡,碳酸钡质量为12.54g-4.66g=7.88g,碳酸钡的物质的量为
=0.02mol;12.54g沉淀是硫酸钡和碳酸钡,碳酸钡质量为12.54g-4.66g=7.88g,碳酸钡的物质的量为![]() =0.04mol, 沉淀C的成分是硫酸钡、碳酸钡,
=0.04mol, 沉淀C的成分是硫酸钡、碳酸钡,
答案为:硫酸钡、碳酸钡;n(BaCO3)=0.04mol,n(BaSO4)=0.02mol;
(2) 由第二份加足量NaOH溶液加热后,收集到0.08ml气体B可知,![]() ,
,
答案为:![]() ;
;
(3) 第二份加足量NaOH溶液加热产生气体,气体是氨气,溶液中一定含有NH4+,且物质的量为0.08mol;由电荷守恒可知,正电荷为:n(NH4+)=0.08mol;负电荷=2c(CO32-)+2c(SO42-)=0.12mol,正电荷总物质的量大于负电荷,故原溶液中一定有K+,至少为0.04mol,该混合液中可能含的离子有Cl-,故原溶液中一定存在CO32-、SO42-、K+、NH4+,一定没有Ca2+、Ba2+,可能含的离子有Cl-,
故答案为:Cl-;K+、NH4+;![]() ;Ca2+、Ba2+。
;Ca2+、Ba2+。


科目:高中化学 来源: 题型:
【题目】按题目要求填写下列空白。
(1) ![]() 按官能团的不同分类,有机物类型为________类。
按官能团的不同分类,有机物类型为________类。
(2)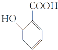 中官能团的名称是________________。
中官能团的名称是________________。
(3)键线式![]() 表示的有机物的结构简式是____________。
表示的有机物的结构简式是____________。
(4)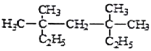 系统命名法为_________________。
系统命名法为_________________。
系统命名法命名有机物时应注意的问题_______ 、 _______(至少写两点)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有甲、乙两个容积相同的密闭容器,甲容器中充入N2和CO的混合气体,乙容器中充入O2,当它们的温度和密度都相同时,下列说法中正确的是
A.两容器中气体的压强相等
B.甲容器中气体的平均摩尔质量与乙容器中气体的摩尔质量相等
C.甲乙两容器气体的质量相等
D.甲乙两容器气体所含原子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y是合成香料、医药、农药及染料的重要中间体,可由X在一定条件下合成如下,下列说法错误的是

A. Y的分子式为![]()
B. 由X制取Y的过程中可得到乙醇
C. 一定条件下,Y能与5mol![]() 发生加成反应
发生加成反应
D. 等物质的量的X、Y分别与![]() 溶液反应,最多消耗
溶液反应,最多消耗![]() 的物质的量之比为1:1
的物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是
A. 溶液中![]() 不变
不变
B. 溶液中导电粒子的数目减少
C. 醋酸的电离程度增大,c(H+)也增大
D. 再加入10 mL pH=11的NaOH溶液后pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中有如下反应:2SO2(g)+O2 (g)![]() 2 SO3(g);△H<0。某研究小组进行了当其他条件不变时,改变某一条件对上述反应影响的研究,下列分析正确的是
2 SO3(g);△H<0。某研究小组进行了当其他条件不变时,改变某一条件对上述反应影响的研究,下列分析正确的是

①图Ⅰ研究的是温度对化学平衡的影响,且乙的温度较高
②图Ⅱ研究的是催化剂对反应速率的影响,化学平衡不移动
③图Ⅱ研究的是t0时刻通入氦气增大体系压强对反应速率的影响
④图Ⅲ研究的是t0时刻增大O2的浓度对反应速率的影响
A. ①②B. ②③C. ②④D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置中, a、b为石墨电极,通电一段时间后,b极附近显红色。下列说法不正确的是

A. b电极反应式为2H++2e-=H2↑B. a电极反应式为2Cl--2e-=Cl2↑
C. 铁电极反应式为Cu2++2e-=CuD. 铜电极反应式为4OH--4e-=O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以高钛渣(主要成分为Ti3O5,含少量SiO2、FeO、Fe2O3)为原料制备白色颜料TiO2的一种工艺流程如下:

已知:Na2TiO3难溶于碱性溶液;H2TiO3中的杂质Fe2+比Fe3+更易水洗除去。
(1)熔盐:
①为加快反应速率,在维持反应物颗粒大小、反应温度一定的条件下,可采取的措施是__________。
②NaOH固体与Ti3O5在空气中加热至500~550 ℃时生成Na2TiO3,该反应的化学方程式为_________。
(2)过滤:
①“滤液”中主要溶质为NaOH,还含有少量________(填化学式)。
②除杂后的滤液中获得的NaOH可循环利用,则“水浸”时,用水量不宜过大的主要原因是_________。
(3)水解:“酸溶”后获得的TiOSO4经加热煮沸,生成难溶于水的H2TiO3,该反应的化学方程式为______。
(4)脱色:H2TiO3中因存在少量Fe(OH)3而影响TiO2产品的颜色,“脱色”步骤中Ti2(SO4)3的作用是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示。则下列离子组在对应的溶液中,一定能大量共存的是( )
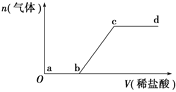
A. a点对应的溶液中:Na+、OH-、SO![]() 、NO
、NO![]()
B. b点对应的溶液中:Al3+、Fe3+、MnO![]() 、Cl-
、Cl-
C. c点对应的溶液中:Na+、Ca2+、NO![]() 、Cl-
、Cl-
D. d点对应的溶液中:F-、NO![]() 、Fe3+、Ag+
、Fe3+、Ag+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com