
【题目】室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是
A. 溶液中![]() 不变
不变
B. 溶液中导电粒子的数目减少
C. 醋酸的电离程度增大,c(H+)也增大
D. 再加入10 mL pH=11的NaOH溶液后pH=7
【答案】A
【解析】
根据醋酸是弱电解质,则室温下向10mLpH=3的醋酸溶液中加水稀释将促进电离,离子的数目增多,但溶液的体积增大,则电离产生的离子的浓度减小,并利用温度与电离常数的关系、酸碱混合时pH的计算来解答。
A.加水稀释时,c(H+)减小,因醋酸的电离平衡常数K=![]() 不变,则
不变,则![]() 不变,A正确;
不变,A正确;
B.醋酸是弱酸,存在电离平衡,在醋酸溶液中加水稀释,促进电离,则溶液中导电粒子的数目增多,B错误;
C.加水稀释时,有更多的醋酸分子发生电离,所以醋酸的电离程度增大,但溶液体积增大的倍数大于n(H+)增加的倍数,则c(H+)减小,C错误;
D.等体积10mLpH=3的醋酸与pH=11的NaOH溶液混合时,由于醋酸的浓度大于0.001mol/L,醋酸过量,故反应后溶液显酸性,pH<7,D错误;
故合理选项是A。


科目:高中化学 来源: 题型:
【题目】氮化镁![]() 是一种重要的化学试剂。某化学兴趣小组拟制备氮化镁并测定产品纯度。
是一种重要的化学试剂。某化学兴趣小组拟制备氮化镁并测定产品纯度。
已知:①氮化镁极易与水反应;②实验室在加热条件下用饱和![]() 溶液和饱和
溶液和饱和![]() 溶液混合制备
溶液混合制备![]() ;③焦性没食子酸溶液用于吸收少量
;③焦性没食子酸溶液用于吸收少量![]() 。
。
Ⅰ.制备氮化镁。
他们选择下列装置设计实验(装置可重复使用):
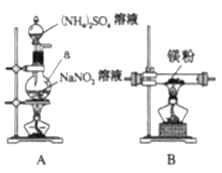

(1)仪器a的名称是____,氮化镁的电子式是____。
(2)气体从左至右,装置连接顺序为____。(填代号)
(3)写出A中发生反应的化学方程式:____。
(4)用化学方法检验产品中含有氮化镁![]() ,设计实验方案:____。
,设计实验方案:____。
Ⅱ.测定产品纯度。
利用如图装置测定氮化镁产品纯度(杂质不产生气体,氨气不溶于煤油)。

(5)当产品与蒸馏水完全反应后,冷却至室温、调平液面、读数。调平液面的操作是__。
(6)取产品质量为wg,开始量气管读数为![]() ,最终量气管读数为
,最终量气管读数为![]() (折合成标准状况),则该样品纯度为____(用代数式表示)。如果开始俯视刻度线,终点时仰视刻度线,则测得结果___(填“偏高”“偏低”或“无影响”)。
(折合成标准状况),则该样品纯度为____(用代数式表示)。如果开始俯视刻度线,终点时仰视刻度线,则测得结果___(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)质量为 3.9 g 的 Na2X 中含有 Na+的物质的量为 0.1mol,则 Na2X 的摩尔质 量为_____。
(2)在标准状况下,1.6 g 某气态氧化物 RO2 体积为 0.56L,R 的相对原子质量为________。
(3)3.01×1022 个 S2- 含有电子的物质的量为_____________。
(4)0.3NA 个硫酸分子与____________ g 磷酸(H3PO4)含有相同的氧原子数。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填写下列空白:
(1)15.8gKMnO4的物质的量是___,所含原子数目为___,其所含氧元素与___molNaClO中所含氧元素的质量相同。
(2)相同条件下,相同质量的Al(OH)3和Na2O2中氧原子的个数比是___;相同物质的量的NH4+与OH-所含电子个数之比为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只含有大量的下列离子:Fe3+、NO3—、K+和M离子,经测定Fe3+、NO3—、K+和M离子的物质的量之比为2:5:1:1,则M离子可能是
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一混合物的水溶液,可能含有以下离子中的几种:![]() 、
、![]() 、
、![]() 、
、![]() 现取三份各100mL溶液进行如下实验:第一份加入
现取三份各100mL溶液进行如下实验:第一份加入![]() 溶液有沉淀A产生:第二份加足量NaOH溶液加热后,收集到0.08ml气体B;第三份加足量
溶液有沉淀A产生:第二份加足量NaOH溶液加热后,收集到0.08ml气体B;第三份加足量![]() 溶液后,得到干燥沉淀C 12.54g,经足量盐酸洗涤干燥后,沉淀质量为4.66g
溶液后,得到干燥沉淀C 12.54g,经足量盐酸洗涤干燥后,沉淀质量为4.66g
请回答以下问题
(1) 沉淀C的成分是_________,其物质的量分别是_____________
(2) 写出产生气体B的离子方程式 ____________________
(3) 该混合液中可能含的离子有___________,一定含有的阳离子有_________其物质的量分别是_____________一定没有的离子是_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组在实验室模拟反应![]() 制备重要的化工原料
制备重要的化工原料![]() 。
。
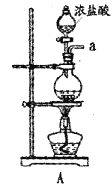
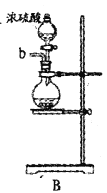
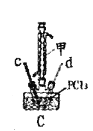
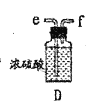
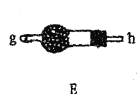
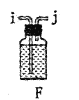
已知:![]() 熔点-93.6℃,沸点76.1℃,遇水极易水解,易与
熔点-93.6℃,沸点76.1℃,遇水极易水解,易与![]() 反应;
反应;![]() 熔点1.25℃,沸点105.8℃,遇水强烈水解,能溶于
熔点1.25℃,沸点105.8℃,遇水强烈水解,能溶于![]() 。
。
(1)装置A中发生反应的离子方程式是__________________。
(2)以上各仪器接口的连接顺序是a→____→____→____→____→cd←g←h←b,装置E中的试剂为无水氯化钙,F中所装的试剂是________。(仪器不重复使用)
(3)装置C制备![]() 。
。
①仪器甲的名称是_______。
②反应温度控制在60~65℃,其原因是______________。
③![]() 发生水解反应生成
发生水解反应生成![]() 和_____________。
和_____________。
(4)该装置不足之处是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去粗盐中的 CaCl2、MgCl2、Na2SO4 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):称取粗盐![]() 滤液
滤液![]() 滤液
滤液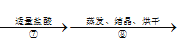 精盐,下列说法不正确的是
精盐,下列说法不正确的是
A.第②步过滤出的滤渣是泥沙
B.在第④步中不能用 KOH 替代 NaOH
C.第⑤步加入 Na2CO3 溶液的目的是除去 Ba2+
D.第③、④、⑤步添加试剂的操作顺序还可以是:NaOH、BaCl2、Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲为恒压容器、乙为恒容容器相同条件下充入等物质的量的![]() 气体,且起始时体积相同,发生反应:2NO2(g)
气体,且起始时体积相同,发生反应:2NO2(g)![]() N2O4(g) H <0 一段时间后相继达到平衡状态下列说法中正确的是( )
N2O4(g) H <0 一段时间后相继达到平衡状态下列说法中正确的是( )
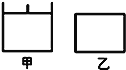
A. 平衡时![]() 体积分数:甲<乙
体积分数:甲<乙
B. 达到平衡所需时间,甲与乙相等
C. 该反应的平衡常数表达式K=![]()
D. 若两容器内气体的压强保持不变,均说明反应已达到平衡状态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com