
【题目】(1)质量为 3.9 g 的 Na2X 中含有 Na+的物质的量为 0.1mol,则 Na2X 的摩尔质 量为_____。
(2)在标准状况下,1.6 g 某气态氧化物 RO2 体积为 0.56L,R 的相对原子质量为________。
(3)3.01×1022 个 S2- 含有电子的物质的量为_____________。
(4)0.3NA 个硫酸分子与____________ g 磷酸(H3PO4)含有相同的氧原子数。
【答案】78g/mol 32 0.9mol 29.4
【解析】
(1)设Na2X 的摩尔质量为Mg/mol,所以![]() ×2=0.1mol,解得M=78;
×2=0.1mol,解得M=78;
故答案是:78g/mol;
(2)0.56L某气态氧化物 RO2的物质的量为![]() =0.025mol;RO2的摩尔质量为1.6g÷0.025mol=64g/mol,则RO2的相对分子质量为64,R的相对原子质量为64-2×16=32;
=0.025mol;RO2的摩尔质量为1.6g÷0.025mol=64g/mol,则RO2的相对分子质量为64,R的相对原子质量为64-2×16=32;
故答案是:32
(3)3.01×1022 个 S2-的物质的量为![]() mol=0.05mol,1个 S2-所含电子数为18,所以0.05mol S2-所含电子的物质的量为0.9mol;
mol=0.05mol,1个 S2-所含电子数为18,所以0.05mol S2-所含电子的物质的量为0.9mol;
故答案是:0.9mol;
(4)0.3NA个硫酸分子中含有氧原子数为0.3NA×4=1.2 NA;则n(H3PO4)=1.2 NA÷NAmol-1÷4=0.3mol,m(H3PO4)=0.3mol×98g/mol=29.4g;
故答案是:29.4。


科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积均为![]() 的恒容密闭容器中按不同方式投入反应物,发生反应
的恒容密闭容器中按不同方式投入反应物,发生反应![]()
![]() ,测得反应的相关数据如下:
,测得反应的相关数据如下:
容器 | 容器Ⅰ | 容器Ⅱ | 容器Ⅲ |
反应温度 | 600 | 600 | 800 |
反应物投入量 |
|
|
|
平衡 |
|
|
|
平衡 |
|
|
|
平衡体系总压强 |
|
|
|
物质的转化率 |
|
|
|
平衡常数K |
|
|
|
下列叙述正确的是( )
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组模拟工业制漂白粉,设计了如下图所示的实验装置。
已知:①氯气与碱反应放出热量。②6Cl2+6Ca(OH)2=5CaCl2+Ca(ClO3)2+6H2O。
试回答下列问题:
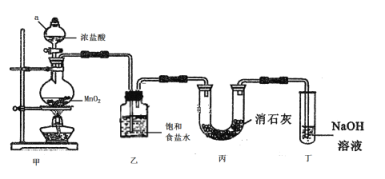
(1)甲装置中仪器a的名称是________________________。
(2)装置乙中饱和食盐水的作用是________________________。
(3)装置丁中发生反应的化学方程式为_____________________。
(4)漂白粉在空气中失效的原因是______________、______________(用化学方程式表示)。
(5)①该小组制得的漂白粉中n(CaCl2)远大于n[Ca(ClO)2],其主要原因是________ 。
②为提高Ca(ClO)2的含量。可采取的措施是___________(任写一种即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下列基团(或官能团)的名称或结构简式:
﹣CH2CH3_______、﹣Br_______、碳碳三键 _______
(2)乙烯的空间构型 _______
(3)乙炔的电子式_______
(4)苯的同系物的通式_______
(5)![]() 分子式:_______
分子式:_______
(6)![]() 其苯环上的一氯代物有_______ 种
其苯环上的一氯代物有_______ 种
(7)2,5﹣二甲基﹣4﹣乙基庚烷(写出结构简式) _______
(8)4,4,5﹣三甲基﹣2﹣己炔(写出结构简式) _______
(9)![]() 的系统命名是_______
的系统命名是_______
(10)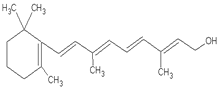 1mol该物质消耗_______molH2,_______molBr2 _______molNa
1mol该物质消耗_______molH2,_______molBr2 _______molNa
(11)鉴别苯,碘化钾溶液,硝酸银溶液,己烯,四氯化碳时,只能用一种试剂,该试剂是_____;
(12)写出C5H8属于炔烃的所有同分异构体__________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用乙醇制取乙烯的装置如下图,回答下列问题。

(1)仪器A的名称是__________ ;A中加入沸石的目的是 __________;在烧杯中配制A中溶液的方法是__________ ;在反应中浓硫酸的作用是__________;A中发生反应的化学方程式是 __________ 。
(2)A中产生的气体除乙烯外,还可能混有少量 __________(填化学式)
(3)用乙烯制聚乙烯的化学方程式为 __________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有甲、乙两个容积相同的密闭容器,甲容器中充入N2和CO的混合气体,乙容器中充入O2,当它们的温度和密度都相同时,下列说法中正确的是
A.两容器中气体的压强相等
B.甲容器中气体的平均摩尔质量与乙容器中气体的摩尔质量相等
C.甲乙两容器气体的质量相等
D.甲乙两容器气体所含原子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将20.0g质量分数为14.0%的KNO3溶液跟30.0g质量分数为24.0%的KNO3溶液混合,得到密度为1.15g/cm3的混合溶液。计算(写出计算步骤):
(1)混合后溶液的质量分数;______________
(2)混合后溶液的物质的量浓度;(保留到小数点后一位,下同)___________
(3)在1 000g水中需溶解多少摩尔KNO3才能使其浓度恰好与上述混合后溶液的浓度相等?__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是
A. 溶液中![]() 不变
不变
B. 溶液中导电粒子的数目减少
C. 醋酸的电离程度增大,c(H+)也增大
D. 再加入10 mL pH=11的NaOH溶液后pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是一种具有抗疟药理活性的喹啉类衍生物,其合成路线流程图如下:

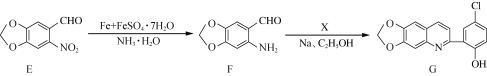
已知:
(1) F中的含氧官能团名称为________、________。
(2) B→C的反应类型为________。
(3)芳香族化合物X的分子式为C8H7ClO2,写出X的结构简式:___________________________。
(4)写出同时满足下列条件的C的一种同分异构体的结构简式:__________________________。
①分子中含有苯环,能与FeCl3溶液发生显色反应,不能发生银镜反应;
②碱性条件水解生成两种产物,酸化后分子中均只有2种不同化学环境的氢。
(5)写出以 为原料制备
为原料制备![]() 的合成路线流程图(无机试剂和乙醇任用,合成路线流程图示例见本题题干)_________________________。
的合成路线流程图(无机试剂和乙醇任用,合成路线流程图示例见本题题干)_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com