
【题目】一定温度下,在三个容积均为![]() 的恒容密闭容器中按不同方式投入反应物,发生反应
的恒容密闭容器中按不同方式投入反应物,发生反应![]()
![]() ,测得反应的相关数据如下:
,测得反应的相关数据如下:
容器 | 容器Ⅰ | 容器Ⅱ | 容器Ⅲ |
反应温度 | 600 | 600 | 800 |
反应物投入量 |
|
|
|
平衡 |
|
|
|
平衡 |
|
|
|
平衡体系总压强 |
|
|
|
物质的转化率 |
|
|
|
平衡常数K |
|
|
|
下列叙述正确的是( )
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
【答案】B
【解析】
先建立“中间过程”,从影响化学平衡移动的因素、等效平衡等角度进行分析;
A、容器Ⅱ相当于开始时充入2molA2和4molB2,其物质的量浓度大于容器I,物质的量浓度越大,反应速率越快,即v1<v2,容器Ⅱ在容器I的基础上再充入1molA2和2molB2,假设平衡不移动,此时c2'=2c1,但再充入1molA2和2molB2,增加反应物浓度平衡向正反应方向进行,c2> c2'=2c1,故A错误;
B、容器Ⅲ在容器I的基础上升高温度,该反应为放热反应,升高温度,平衡向逆反应方向移动,即α1(A2)>α3(A2),温度升高,反应速率加快,即v1<v3,故B正确;
C、容器Ⅱ相当于开始时充入2molA2和4molB2,容器Ⅱ在容器I的基础上再充入1molA2和2molB2,假设平衡不移动,此时p2'=2p1,但再充入1molA2和2molB2,平衡向正反应方向进行,气体物质的量减少,p2< p2'=2p1,容器Ⅲ在容器I的基础上升高温度,该反应为放热反应,升高温度,平衡向逆反应方向移动,容器Ⅲ中气体物质的量大于容器I,即p3>p1,即有p2<2p3,化学平衡常数只受温度的影响,该反应为放热反应,因此K1>K3,故C错误;
D、根据选项A的分析,c2> c2'=2c1,容器Ⅲ在容器I的基础上升高温度,该反应为放热反应,升高温度,平衡向逆反应方向移动,c1>c3,即c2>2c3,容器Ⅱ如果通入2molAB2,则与容器I为等效平衡,α1(A2)+α2'(AB2)=1,根据上面的分析,α2' (AB2)>α(AB2) α1(A2)+α2(AB2)<1,根据B选项分析,α1(A2)>α3(A2),则有α2(AB2)+α3(A2)<1,故D错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】通过海水晾晒可以得到粗盐,粗盐除还有NaCl外,还含有MgCl2、 CaCl2、 Na2SO4以及泥沙等杂质。以下是某兴趣小组制备精盐的实验方案,各步操作流程如下。下列说法正确的是
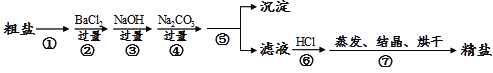
A. 实验过程中①、⑤步骤的操作分别是溶解、过滤
B. 实验过程中步骤④的目的是仅除去溶液中的Ca2+
C. 实验过程中步骤⑦中的蒸发所用到的仪器是酒精灯、玻璃棒、烧杯、铁架台(带铁圈)
D. 实验过程中②、④步骤互换,对实验结果不影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类文明进步息息相关,下列说法错误的是( )
A. 蚕丝的主要成分是蛋白质,属于天然高分子材料
B. 汉代烧制出“明如镜、声如磬”的瓷器,主要化学成分是硅酸盐
C. 2022年冬奥会聚氨酯速滑服,是无机非金属材料
D. 城市公交系统推广的清洁燃料压缩天然气“![]() ”、液化石油气“
”、液化石油气“![]() ”,主要成分都是烃
”,主要成分都是烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某工业废水中含有大量FeSO4,较多的Cu2+,极少量的Na+ 以及部分污泥,通过下列流程可从该废水中回收FeSO4·7H2O晶体及金属Cu。
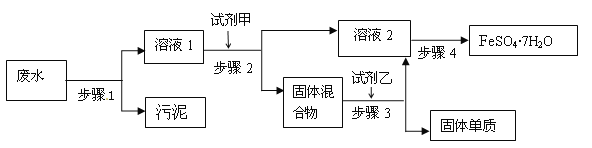
(1)步骤1的主要操作是___,需用到的玻璃仪器除烧杯外还有___。
(2)固体混合物是____(填化学式)
(3)步骤3中发生反应的化学方程式为___。
(4)步骤4中涉及的操作是:蒸发浓缩、___、过滤、洗涤、干燥。
(5)火法制得的粗铜中常混有少量氧化亚铜(Cu2O),氧化亚铜溶于稀硫酸溶液变蓝。试写出该反应的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
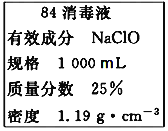
①该“84消毒液”的物质的量浓度约为___mol·L-1。(保留小数点后一位)
②某同学取100mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=___mol·L-1。
(2)从矿物学资料查得,二硫化亚铁和硫酸铜在一定条件下发生反应:14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4。
当有2.5molFeS2参加反应时,氧化产物的物质的量为__mol,转移的电子__mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研制了一种新型的高比能量锌—碘溴液流电池,其工作原理如图所示。图中贮液器可储存电解质溶液,提高电池的容量。下列叙述不正确的是( )

A. 放电时,a电极反应为I2Br-+2e-=2I-+Br-
B. 充电时,b电极每增重0.65g,溶液中有0.01mol I-被氧化
C. 放电时,溶液中离子的数目增大
D. 充电时,a电极接外电源正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置能达到实验目的的是( )
A. 实验室制取氨气
B. 测定化学反应速率
C. 验证非金属性:N﹥C﹥Si
D. 实现反应:Cu+2H2O![]() Cu(OH)2+H2
Cu(OH)2+H2![]()

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化镁![]() 是一种重要的化学试剂。某化学兴趣小组拟制备氮化镁并测定产品纯度。
是一种重要的化学试剂。某化学兴趣小组拟制备氮化镁并测定产品纯度。
已知:①氮化镁极易与水反应;②实验室在加热条件下用饱和![]() 溶液和饱和
溶液和饱和![]() 溶液混合制备
溶液混合制备![]() ;③焦性没食子酸溶液用于吸收少量
;③焦性没食子酸溶液用于吸收少量![]() 。
。
Ⅰ.制备氮化镁。
他们选择下列装置设计实验(装置可重复使用):
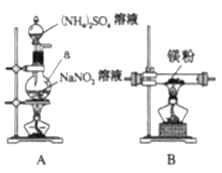
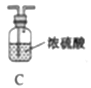

(1)仪器a的名称是____,氮化镁的电子式是____。
(2)气体从左至右,装置连接顺序为____。(填代号)
(3)写出A中发生反应的化学方程式:____。
(4)用化学方法检验产品中含有氮化镁![]() ,设计实验方案:____。
,设计实验方案:____。
Ⅱ.测定产品纯度。
利用如图装置测定氮化镁产品纯度(杂质不产生气体,氨气不溶于煤油)。

(5)当产品与蒸馏水完全反应后,冷却至室温、调平液面、读数。调平液面的操作是__。
(6)取产品质量为wg,开始量气管读数为![]() ,最终量气管读数为
,最终量气管读数为![]() (折合成标准状况),则该样品纯度为____(用代数式表示)。如果开始俯视刻度线,终点时仰视刻度线,则测得结果___(填“偏高”“偏低”或“无影响”)。
(折合成标准状况),则该样品纯度为____(用代数式表示)。如果开始俯视刻度线,终点时仰视刻度线,则测得结果___(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)质量为 3.9 g 的 Na2X 中含有 Na+的物质的量为 0.1mol,则 Na2X 的摩尔质 量为_____。
(2)在标准状况下,1.6 g 某气态氧化物 RO2 体积为 0.56L,R 的相对原子质量为________。
(3)3.01×1022 个 S2- 含有电子的物质的量为_____________。
(4)0.3NA 个硫酸分子与____________ g 磷酸(H3PO4)含有相同的氧原子数。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com