
【题目】(1)已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
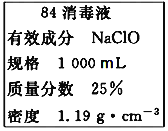
①该“84消毒液”的物质的量浓度约为___mol·L-1。(保留小数点后一位)
②某同学取100mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=___mol·L-1。
(2)从矿物学资料查得,二硫化亚铁和硫酸铜在一定条件下发生反应:14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4。
当有2.5molFeS2参加反应时,氧化产物的物质的量为__mol,转移的电子__mol。
【答案】4.0 0.04 1.5 10.5
【解析】
根据题中84消毒液的标签可知,本题考查配制一定物质的量浓度的溶液的相关计算,根据![]() 及稀释前后溶质物质的量不变分析
及稀释前后溶质物质的量不变分析
① 根据25%NaClO、1000mL、密度1.19gcm-3,![]()
故答案为:4.0
②稀释前后溶质的物质的量不变,所以稀释后![]() ,
,
故答案为:0.04
(2)由 14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4可知,反应中转移电子数和氧化产物(FeSO4)、FeS2的关系为:21e- ~3FeSO4~5FeS2, 因此当有2.5molFeS2参加反应时,氧化产物的物质的量为1.5mol,转移的电子10.5mol。
故答案为:1.5 10.5


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
【题目】有机物的结构可用“键线式”简化表示。CH3—CH=CH-CH3可简写为 ![]() 。有机物X的键线式为:
。有机物X的键线式为:

(1)有机物X的分子式___________________
(2)有机物Y是X的同分异构体,属于芳香烃,写出Y的结构简式 _______________________________________________________
(3)X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有_________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.碘是人体不可缺乏的元素,为了防止碘缺乏,现在市场上流行一种加碘盐,就是在精盐中添加一定量的KIO3进去。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关的资料,发现其检测原理是:KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4
(1)该反应的氧化剂是____;氧化产物与还原产物的物质的量比是___;如果反应生成0.3mol的单质碘,则转移的电子数目是____。
(2)若采用下图实验装置将四氯化碳和I2的混合溶液分离。
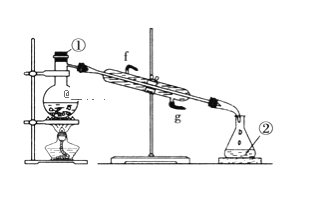
写出图中仪器的名称:①____;该装置还缺少的仪器是__;冷凝管的进水口是:__(填g或f)。
Ⅱ.我校环保兴趣小组在处理污水样品时,需用质量分数为36.5%的浓盐酸密度为1.19 g/cm3配制成250mL 0.1mol·L-1的盐酸溶液。
(1)配制上述溶液除250mL容量瓶、烧杯、胶头滴管、量筒外还需要的玻璃仪器是___。
(2)根据计算,需要36.5%的浓盐酸的体积为______mL。
(3)在量取浓盐酸后,下列操作先后顺序是(用编号表示)_______。
① 待稀释的盐酸温度与室温一致后,沿玻璃棒注入所选定规格的容量瓶中。
② 往容量瓶中小心加蒸馏水至液面接近环形刻度线1~2 cm处,改用胶头滴管加蒸馏水,使凹液面最低处与瓶颈的环形刻度线相切。
③ 在盛盐酸的烧杯中注入适量蒸馏水,并用玻璃棒搅动,使其混合均匀。
④ 用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
(4)假设配制时其他操作均正确,只出现以下哪种情况时,会造成所配制的溶液浓度相比于要求的值偏高? (______)
A.容量瓶中有少量蒸馏水
B.定容时仰视容量瓶读数
C.定容时俯视容量瓶读数
D.配制的溶液装入洁净的但有少量蒸馏水的试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知氯气通入热的苛性钠溶液中会发生如下反应:3Cl2+6NaOH=5NaCl+NaClO3+3H2O反应中还原剂是___(填化学式);把此反应改写成离子方程式:___;
(2)用“双线桥”表示下列氧化还原反应中电子转移的方向和数目:3Cl2+6NaOH=5NaCl +NaClO3+3H2O。___
(3)若生成1mol的NaClO3,转移的电子数是___;若反应中转移了2.5mol的电子,则消耗标况下Cl2的体积是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学上通常把原子数和电子数相等的分子或离子称为等电子体,研究发现等电子体间结构和性质相似(等电子原理).化合物B3N3H6被称为无机苯,它与苯是等电子体,则下列说法中不正确的是( )
A. 无机苯是仅由极性键组成的分子
B. 无机苯能发生取代反应
C. 无机苯的二氯代物有3种同分异构体
D. 无机苯不能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积均为![]() 的恒容密闭容器中按不同方式投入反应物,发生反应
的恒容密闭容器中按不同方式投入反应物,发生反应![]()
![]() ,测得反应的相关数据如下:
,测得反应的相关数据如下:
容器 | 容器Ⅰ | 容器Ⅱ | 容器Ⅲ |
反应温度 | 600 | 600 | 800 |
反应物投入量 |
|
|
|
平衡 |
|
|
|
平衡 |
|
|
|
平衡体系总压强 |
|
|
|
物质的转化率 |
|
|
|
平衡常数K |
|
|
|
下列叙述正确的是( )
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 25℃时,加水稀释0.1mol/LNH4Cl,溶液中![]() 增大
增大
B. 反应2NO+O2=2NO2常温下可自发进行,该反应为吸热反应
C. 用NaOH标准溶液滴定未知浓度的CH3COOH溶液时,使用酚酞作指示剂
D. 铜的化学性质比铁稳定,在铁闸上安装铜块可减慢铁闸的腐蚀速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见元素A、B、M组成的四种物质发生反应:甲+乙=丙+丁,其中甲由A和M组成,乙由B和M组成,丙中只含有M。
(1)若甲为淡黄色固体,乙和丙均为常温下的无色无味气体。则甲中含有的化学键类型是___;常温下丁溶液显___性(填“酸”或“碱”或“中”),原因是____(用离子方程式表示);
(2)若丁为能使品红褪色的无色气体,丁与水反应生成戊,丙为常见红色金属,化合物甲、乙中原子个数比均为1∶2(M均显+1价),原子序数B大于A。回答下列问题:
①写出加热条件下上述生成丙的化学方程式____;
②已知常温下弱电解质的电离平衡常数如下:一水合氨![]() ,戊:
,戊:![]() ,
,![]() 。若一水合氨与丁恰好完全反应生成酸式盐,则浓度为
。若一水合氨与丁恰好完全反应生成酸式盐,则浓度为![]() 的该盐溶液pH___7(填“>”“<”或“=”);调整二者反应的比值可使溶液呈中性,此时溶液中
的该盐溶液pH___7(填“>”“<”或“=”);调整二者反应的比值可使溶液呈中性,此时溶液中![]() ____
____![]() (同上)。
(同上)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用乙醇制取乙烯的装置如下图,回答下列问题。

(1)仪器A的名称是__________ ;A中加入沸石的目的是 __________;在烧杯中配制A中溶液的方法是__________ ;在反应中浓硫酸的作用是__________;A中发生反应的化学方程式是 __________ 。
(2)A中产生的气体除乙烯外,还可能混有少量 __________(填化学式)
(3)用乙烯制聚乙烯的化学方程式为 __________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com