
【题目】常见元素A、B、M组成的四种物质发生反应:甲+乙=丙+丁,其中甲由A和M组成,乙由B和M组成,丙中只含有M。
(1)若甲为淡黄色固体,乙和丙均为常温下的无色无味气体。则甲中含有的化学键类型是___;常温下丁溶液显___性(填“酸”或“碱”或“中”),原因是____(用离子方程式表示);
(2)若丁为能使品红褪色的无色气体,丁与水反应生成戊,丙为常见红色金属,化合物甲、乙中原子个数比均为1∶2(M均显+1价),原子序数B大于A。回答下列问题:
①写出加热条件下上述生成丙的化学方程式____;
②已知常温下弱电解质的电离平衡常数如下:一水合氨![]() ,戊:
,戊:![]() ,
,![]() 。若一水合氨与丁恰好完全反应生成酸式盐,则浓度为
。若一水合氨与丁恰好完全反应生成酸式盐,则浓度为![]() 的该盐溶液pH___7(填“>”“<”或“=”);调整二者反应的比值可使溶液呈中性,此时溶液中
的该盐溶液pH___7(填“>”“<”或“=”);调整二者反应的比值可使溶液呈中性,此时溶液中![]() ____
____![]() (同上)。
(同上)。
【答案】离子键、共价键 碱 CO32-+H2O![]() HCO3-+OH- 2Cu2O+Cu2S
HCO3-+OH- 2Cu2O+Cu2S ![]() 6Cu+SO2↑ < <
6Cu+SO2↑ < <
【解析】
(1)甲为淡黄色固体,且乙和丙均为常温下的无色无味的气体,则甲为Na2O2,乙为CO2,该反应为2Na2O2+2CO2=2Na2CO3+O2,过氧化钠的电子式为![]() ,过氧化钠中含有离子键和非极性共价键;丁为Na2CO3,属于强碱弱酸盐,CO32-发生水解:CO32-+H2O
,过氧化钠中含有离子键和非极性共价键;丁为Na2CO3,属于强碱弱酸盐,CO32-发生水解:CO32-+H2O![]() HCO3-+OH-、HCO3-+OH-
HCO3-+OH-、HCO3-+OH-![]() H2CO3+OH-;
H2CO3+OH-;
答案为离子键、(非极性)共价键; 碱;CO32-+H2O![]() HCO3-+OH-、HCO3-+OH-
HCO3-+OH-、HCO3-+OH-![]() H2CO3+OH-;
H2CO3+OH-;
(2)丁能使品红溶液褪色的无色气体,即丁为SO2,SO2与H2O反应生成H2SO3,丙为常见红色金属,则丙为Cu,这三种元素为O、S、Cu,甲、乙中原子个数比均为1∶2(M均显+1价),且原子序数B大于A,则甲为Cu2O,乙为Cu2S,
①该反应的方程式为2Cu2O+Cu2S ![]() 6Cu+SO2↑;
6Cu+SO2↑;
答案为:2Cu2O+Cu2S ![]() 6Cu+SO2↑;
6Cu+SO2↑;
②NH3·H2O与SO2反应生成酸式盐,该酸式盐为NH4HSO3,NH4+水解常数为![]() , HSO3-水解常数为Kh=
, HSO3-水解常数为Kh=![]() =
=![]() <6.3×10-8,HSO3-的电离程度大于其水解程度,NH4+的水解程度小于HSO3-的电离程度,溶液显酸性,即pH<7;根据电荷守恒,因此有c(H+)+c(NH4+)=c(HSO3-)+2c(SO32-)+c(OH-),溶液显中性,即c(H+)=c(OH-),因此有c(NH4+)=c(HSO3-)+2c(SO32-),因此有
<6.3×10-8,HSO3-的电离程度大于其水解程度,NH4+的水解程度小于HSO3-的电离程度,溶液显酸性,即pH<7;根据电荷守恒,因此有c(H+)+c(NH4+)=c(HSO3-)+2c(SO32-)+c(OH-),溶液显中性,即c(H+)=c(OH-),因此有c(NH4+)=c(HSO3-)+2c(SO32-),因此有![]() <
<![]() ;
;
答案为<;<。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某温度下,向一定体积 0.1mol/L 醋酸溶液中逐滴加入等浓度的 NaOH 溶液,溶液中pOH 与 pH 的变化关系如图所示,则正确的是( )
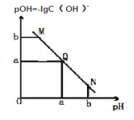
A. M 点所示溶液导电能力强于 Q 点
B. N 点所示溶液中 c(Na+)>c(CH3COO-)
C. Q 点所示的溶液 pH 一定等于 7
D. Q 点加入 NaOH 溶液的体积等于醋酸溶液的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
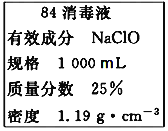
①该“84消毒液”的物质的量浓度约为___mol·L-1。(保留小数点后一位)
②某同学取100mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=___mol·L-1。
(2)从矿物学资料查得,二硫化亚铁和硫酸铜在一定条件下发生反应:14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4。
当有2.5molFeS2参加反应时,氧化产物的物质的量为__mol,转移的电子__mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置能达到实验目的的是( )
A. 实验室制取氨气
B. 测定化学反应速率
C. 验证非金属性:N﹥C﹥Si
D. 实现反应:Cu+2H2O![]() Cu(OH)2+H2
Cu(OH)2+H2![]()

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表中短周期的一部分,表中所列字母分别代表一种元素。

(1)上述元素的单质中熔点最高的可能是________(填字母);dh4比gh4稳定,其原因是______。
(2)f和a所形成的物质的沸点在f相应主族元素的同类型化合物中比较高,其原因是_____________。
(3)f的氢化物属于___晶体,a与d形成的化合物da4的立体构型是___,它的晶体属于_____晶体。
(4) c、i、j可组成离子化合物cxij6,其晶胞结构如下图所示,阳离子c+(用○表示)位于正方体棱的中点和正方体内部;阴离子ij6x-(用●表示)位于该正方体的顶点和面心。该化合物的化学式是________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化镁![]() 是一种重要的化学试剂。某化学兴趣小组拟制备氮化镁并测定产品纯度。
是一种重要的化学试剂。某化学兴趣小组拟制备氮化镁并测定产品纯度。
已知:①氮化镁极易与水反应;②实验室在加热条件下用饱和![]() 溶液和饱和
溶液和饱和![]() 溶液混合制备
溶液混合制备![]() ;③焦性没食子酸溶液用于吸收少量
;③焦性没食子酸溶液用于吸收少量![]() 。
。
Ⅰ.制备氮化镁。
他们选择下列装置设计实验(装置可重复使用):
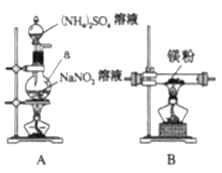
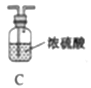

(1)仪器a的名称是____,氮化镁的电子式是____。
(2)气体从左至右,装置连接顺序为____。(填代号)
(3)写出A中发生反应的化学方程式:____。
(4)用化学方法检验产品中含有氮化镁![]() ,设计实验方案:____。
,设计实验方案:____。
Ⅱ.测定产品纯度。
利用如图装置测定氮化镁产品纯度(杂质不产生气体,氨气不溶于煤油)。

(5)当产品与蒸馏水完全反应后,冷却至室温、调平液面、读数。调平液面的操作是__。
(6)取产品质量为wg,开始量气管读数为![]() ,最终量气管读数为
,最终量气管读数为![]() (折合成标准状况),则该样品纯度为____(用代数式表示)。如果开始俯视刻度线,终点时仰视刻度线,则测得结果___(填“偏高”“偏低”或“无影响”)。
(折合成标准状况),则该样品纯度为____(用代数式表示)。如果开始俯视刻度线,终点时仰视刻度线,则测得结果___(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A只由C、H、O三种元素组成,常用作有机合成的中间体,测得8.4g该有机物经燃烧生成22.0g CO2和7.2g水,质谱图表明其相对分子质量为84;红外光谱分析表明A中含有-OH和位于分子端的-C≡C-,核磁共振氢谱显示有3种峰,峰面积之比为6:1:1。
(1)写出A的分子式___________;
(2)写出A的结构简式__________;
(3)下列物质一定能与A发生反应的是_______(填序号)。
A.H2 B.Na C.Br2 D.O2(Cu作催化剂)
解决该题的关键环节为A结构的确定,在解决(2)时,你用到了题干中的哪些谱图信息_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象与实验操作不相匹配的是
实验操作 | 实验现象 | |
A | 向盛有高锰酸钾酸性溶液的试管中通入足量的乙烯后静置 | 溶液的紫色逐渐褪去,静置后溶液分层 |
B | 将镁条点燃后迅速伸入集满CO2的集气瓶 | 集气瓶中产生浓烟并有黑色颗粒产生 |
C | 向盛有饱和硫代硫酸钠溶液的试管中滴加稀盐酸 | 有刺激性气味气体产生,溶液变浑浊 |
D | 向盛有FeCl3溶液的试管中加过量铁粉,充分振荡后加1滴KSCN溶液 | 黄色逐渐消失,加KSCN后溶液颜色不变 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只含有大量的下列离子:Fe3+、NO3—、K+和M离子,经测定Fe3+、NO3—、K+和M离子的物质的量之比为2:5:1:1,则M离子可能是
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com